VARIABILITY OF CYTOGENETIC INDICATORS OF SEED OFFSPRING OF WALNUT (JUGLANS REGIA L.) DURING INTRODUCTION IN THE VORONEZH REGION
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №3, 2021
Publication text (PDF):Download
UDK: 630*165.4: 634.511:631.529
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Kalaev V. N., Voronezh State University, Voronezh, Russia
Karpova S. S., Voronezh State Institute of Physical Culture, Voronezh, Russia
Al-Khachami F. R. H., Voronezh State University, Voronezh, Russia
Ignatova I. V., Voronezh State University, Voronezh, Russia
Slavskiy V. A., Voronezh State Forest Engineering University named after G. F. Morozov, Voronezh, Russia
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-3-68-86
PAGES:from 68 to 86
STATUS:Published
LANGUAGE:Russian
KEYWORDS: cytogenetic characteristics, walnut, mitotic activity, pathological mitoses, nucleolar characteristics, introduction.
ABSTRACT (ENGLISH):
The article discuss the results of cytogenetic studies of seed offspring of walnut (Juglans regia L.), which is an introduced species in the Voronezh region. Modern ideas about the level of adaptation of introduced plants should be based on an assessment of the cytological foundations of heredity of seed progeny. This will make possible to reveal the level of stability of the genetic system of plants growing outside the habitat conditions usual for a given species. Nuts of the 2017 harvest were collected from mother plants of 30-35 years of age of seed origin, growing on private farmsteads in Voronezh. To study the cytogenetic characteristics, squashed preparations were prepared according to the standard technique. The following cytogenetic characteristics were studied in the root meristem of seed seedlings: mitotic activity, cell fractions at various stages of mitosis, the level and spectrum of mitosis pathologies, the size of nucleoli and the spectrum of their types, and the occurrence of cells with a persistent nucleolus at the stage of metaphase, anaphase and telophase of mitosis. Statistical data processing was performed using the statistical software package Stadia 7.0 Professional (InCo, Russia) and MedCalc 17.5.3. (MedCalc Software, Osten, Belgium). The presence of three polymorphic groups of seedlings according to the studied cytogenetic parameters was revealed: mutable (with a high level of pathological mitosis), low-mutable (with a low level of cytogenetic disorders), and intermediate. The cytogenetic characteristics for each of the selected groups of seedlings were described in detail. The mechanisms of homeostasis maintaining at the cellular level are discussed for above polymorphic groups. A small proportion of seedlings with a high level of cytogenetic abnormalities (7.5 %) and the predominance of seedlings with average (70 %) and low (22.5 %) values of pathological mitoses indicate a high degree of adaptation of the parent trees of the introduced walnut to the environmental conditions of the Voronezh region. Using ROC-analysis, predictors have been established for assigning any seedling to one of the selected model groups (mutable or low mutable). These predictors were: the proportions of cells at the prophase and metaphase stages, the level of pathological mitoses with and without prophase, the frequency of vacuolated and compact nucleoli. The obtained data of cytogenetic studies can be used to develop recommendations for improving the system of seed production and selection of new forms of walnuts.
ВВЕДЕНИЕ
Орех грецкий (Juglans regia L.) по праву занимает ведущее место среди орехоплодных культур в России по потреблению, однако продукция, поступающая на российский рынок, имеет преимущественно зарубежное происхождение. Родина грецкого ореха – территория Средней и Малой Азии. Этот вид относят к теплолюбивым породам, которые хорошо растут и плодоносят в условиях мягкого теплого климата с постепенной сменой сезонов года, поэтому современный ареал дикого и культурного произрастания грецкого ореха составляют территории Китая и Индии, Средней Азии, южная и центральная части Европы, Северный Кавказ, Закавказье, Узбекистан и Молдавия. Территории России располагает достаточным количеством площадей, пригодных для разведения данной культуры, но сама отрасль ореховодства развита слабо. В связи с этим перед селекционерами стоят задачи в подробном и всестороннем изучении ореха грецкого, выделении наиболее ценных форм и разведения устойчивых растений с плодами высокого качества [1–3].
В последние десятилетия проведено немало исследований биологических и экологических показателей ореха грецкого в условиях интродукции в различных странах и в России. В научной литературе отмечается, что орех грецкий успешно произрастает и стабильно плодоносит на территории Центрального Черноземья [4–8], однако его биологические особенности в условиях интродукции еще не достаточно изучены. Современные представления об уровне адаптации интродуцированных растений должны базироваться на оценке цитологических основ наследственности семенного потомства. Это позволит выявить уровень стабильности генетической системы растений, произрастающих вне привычных для данного вида условий обитания [9, 10]. Цитогенетические методы также используются для выявления полиморфизма в природных популяциях, который может носить адаптивный характер и отражать степень приспособленности растений к условиям обитания [11, 12].
Ранее проводилось изучение вариабельности цитогенетических характеристик у семенного потомства лиственных лесообразующих пород Центрального Черноземья – дуба черешчатого (Quercus robur L.) и березы повислой (Betula pendula Roth) [13–18]. Было показано, что на изменения цитогенетических показателей и семенного потомства данных видов растений оказывают влияние условия произрастания материнских деревьев. В неблагоприятных условиях происходит изменение уровня митотической активности (усиление или депрессия), возрастает количество и расширяется спектр патологических митозов, изменяется синтетическая активность ядрышек. У семенного потомства указанных аборигенных видов древесных растений выявлен цитогенетический полиморфизм, заключающийся в существовании нескольких групп проростков, различающихся по степени стабильности генетического материала (мутабильная, слабомутабильная и одна или несколько промежуточных групп). Для дуба черешчатого было установлено, что проростки из группы с высоким уровнем цитогенетических нарушений и низкой ядрышковой активностью обладали худшими ростовыми показателями [15]. Подобные исследования были проведены и для рододендрона Ледебура (Rhododendron ledebourii Pojark.), являющегося интродуцентом Центрального Черноземья [19].
В связи с изложенным выше целью нашего исследования явилось выявление вариабельности цитогенетических показателей семенного потомства деревьев ореха грецкого, длительное время произрастающих в условиях Воронежской области.
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения эксперимента были отобраны 4 фенотипически нормальных, без повреждения вредителями и грибными заболеваниями дерева ореха грецкого семенного происхождения в возрасте 33–35 лет (высота 11–12 м, диаметр ствола (см) на высоте 1,3 м – 36, 40, 40, 24 (у последнего дерева ветвление начинается на высоте 1 м, где диаметр ствола составил 48 см), диаметр кроны – 4–5 м), произрастающие на частных приусадебных подворьях в г. Воронеже (51° 42′ 44″ северной широты; 39° 12′ 3″ (39° 13′ 52″) восточной долготы, высота над уровнем моря – 156 м). Почва в месте произрастания – обыкновенный чернозем, глубина залегания грунтовых вод – 8,5–9 м. Маточное дерево этой формы произрастает в Звенигорском районе Киевской области (Украина). Они расположены на небольшом склоне, в верхней его части и защищены постройками.
Плоды ореха урожая 2017 г. в количестве 200 штук были поставлены на проращивание во влажном песке при температуре 16–18 °С, без проведения стратификации в 9 ч утра. Фиксацию проростков и изготовление микропрепаратов проводили по общепринятой методике [16]. Было просмотрено на микроскопе Laboval-4 (Carl Zeiss, Jena) 40 микропрепаратов (1 проросток – 1 микропрепарат). На каждом препарате учитывали общее количество просмотренных клеток (не менее 700) и клеток на различных стадиях митоза, количество и типы нарушений митотического деления (в соответствии с классификацией Алова [20]), количество клеток с остаточным ядрышком на стадии метафазы, анафазы, телофазы. На основании полученных данных вычисляли митотический индекс, долю патологических митозов, долю каждого типа нарушений клеточного деления и долю клеток с остаточными ядрышками на стадиях метафазы – анафазы митоза (%).
Для изучения ядрышковых характеристик в клетках корневой меристемы семенного потомства ореха грецкого производили измерение диаметра ядрышек с помощью насадки-микрометра (анализировали по 200 клеток на каждом микропрепарате) и высчитывали площадь поверхности ядрышек (мкм2); учитывали количество клеток с разным числом ядрышек и вычисляли их долю (%); определяли долю (%) ядрышек различных типов по классификации, предложенной Челидзе и Зацепиной [21].
Статистическую обработку данных проводили с использованием пакета статистических программ Stadia 7.0 Professional (InCo, Россия). Процедура группировки данных и их обработки изложена в работе Калаевой с соавт. [22]. Цитогенетические характеристики проростков ореха грецкого сравнивали по следующим критериям: частоты встречаемости клеток с остаточными ядрышками и патологиями митоза – по непараметрическому Х-критерию рангов Ван-дер-Вардена, митотический индекс, долю клеток по стадиям митоза и ядрышковые характеристики – по параметрическому t-критерию Стьюдента. Cравнение долей различных типов патологий митоза проводили с использованием Z-апроксимации для критерия равенства частот. Для определения корреляционных зависимостей использовали коэффициент корреляции рангов Спирмена (rS). Коэффициент вариации (Cv) считали согласно рекомендациям Лакина [23]. Низким считали Cv, значение которого не превышало 10 %, средним – 10–25 %, высоким – более 25 %.
Кластерный анализ проводили с использованием метрики нормированный Эвклид, стратегия группировки – группового соседа. В матрицу данных вносили все изученные цитогенетические показатели. Правильность классификации проростков и отнесения их в ту или иную группу была подтверждена результатами дискриминантного анализа с использованием критерия Махаланобиса.
Для определения предикторов отнесения проростков к мутабильной или слабомутабильной группе использовали метод ROC-анализа [24] в программе для статистического анализа биомедицинских исследований MedCalc 17.5.3. (MedCalc Software, Osten, Belgium). Прогностические свойства цитогенетических показателей оценивали по следующим параметрам: AUC (area under curve) – площадь под кривой (0,9–1,0 – отличная диагностическая ценность показателя, 0,8–0,9 – очень хорошая, 0,7–0,8 – хорошая, 0,6–0,7 – средняя, 0,6 и менее – неудовлетворительная); чувствительность и специфичность теста; критические значения («точки отсечения», «cut-off point») показателей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Средние значения цитогенетических показателей семенного потомства ореха грецкого представлены в таблице 1.
Таблица 1.
Цитогенетические характеристики семенного потомства деревьев ореха грецкого, произрастающих в условиях Воронежской области
|
Цитогенетические показатели |
Среднее значение |
Пределы варьирования (95 %-ный доверительный интервал) |
Коэффициент вариации (Cv), % |
|
1 |
2 |
3 |
4 |
|
Митотический индекс, % |
5,8±0,4 |
от 5,0 до 6,5 |
39,7 |
|
Митотический индекс без учета клеток на стадии профазы, % |
3,8±0,3 |
от 3,2 до 4,3 |
44,7 |
|
Доля клеток на стадии профазы, % |
34,5±2,5 |
от 29,6 до 39,6 |
45,7 |
|
Доля клеток на стадии метафазы, % |
18,1±1,4 |
от 15,4 до 20,9 |
47,5 |
|
Доля клеток на стадии анафазы-телофазы, % |
47,4±1,9 |
от 44,0 до 51,5 |
24,7 |
|
Уровень патологий митоза, % |
6,0±0,8 |
от 4,4 до 7,6 |
83,3 |
|
Уровень патологий митоза без учета клеток на стадии профазы, % |
9,1±1,1 |
от 6,9 до11,3 |
78,0
|
|
Частота встречаемости остаточных ядрышек в митозе, % |
0,6±0,2 |
от 0,2 до 1,0 |
87,8 |
|
Частота встречаемости клеток с двумя и более ядрышками в ядре, % |
2,3±0,2 |
от 1,9 до 2,7 |
59,0 |
|
Частота встречаемости ядрышек типа «кора-сердцевина», % |
66,7±3,0 |
от 60,7 до 72,3 |
62,5 |
|
Частота встречаемости ядрышек типа «кора-сердцевина» с вакуолью, % |
30,2±3,0 |
от 24,3 до 36,1 |
29,0 |
|
Частота встречаемости вакуолизированных ядрышек, % |
0,2±0,1 |
от 0 до 0,4 |
373,7 |
|
Частота встречаемости компактных ядрышек, % |
3,0±1,2 |
от 0,6 до 5,4 |
254,2 |
Продолжение таблицы 1.
|
1 |
2 |
3 |
4 |
|||
|
Площадь поверхности ядрышек в клетках с 1 ядрышком в ядре, мкм2 |
85,5±2,0 |
от 81,7 до 89,4 |
14,5 |
|||
|
Площади поверхности ядрышек типа «кора-сердцевина», мкм2 |
81,1±1,7 |
от 77,8 до 84,3 |
18,8 |
|||
|
Площади поверхности ядрышек типа «кора-сердцевина» с вакуолью, мкм2 |
101,7±3,0 |
от 95,8 до 107,6 |
13,1 |
|||
|
Площади поверхности вакуолизированных ядрышек, мкм2 |
74,6±2,5 |
от 73,1 до 76,2 |
6,7 |
|||
|
Площади поверхности компактных ядрышек, мкм2 |
36,6±3,1 |
от 32,8 до 40,4 |
33,6 |
|||
Нами было показано, что в целом по средним значениям всех изученных цитогенетических критериев, показатели семенного потомства ореха грецкого сопоставимы с таковыми как у аборигенных видов лиственных древесных растений (дуб черешчатый, береза повислая), так и других лиственных интродуцентов (различные виды рододендронов, катальпы), длительное время произрастающих в условиях Воронежской области [11–19, 25]. Это свидетельствует о высоком уровне адаптации ореха грецкого к новым для данного вида условиям произрастания.
Распределение клеток по стадиям митоза в корневой меристеме проростков ореха грецкого отражает продолжительность разных стадий митоза в нормальных физиологических условиях: наибольшие значения отмечались у показателей «доля клеток на стадии профазы» и «доля клеток на стадии анафазы-телофазы митоза», т.е. на стадиях, связанных с процессами синтеза.
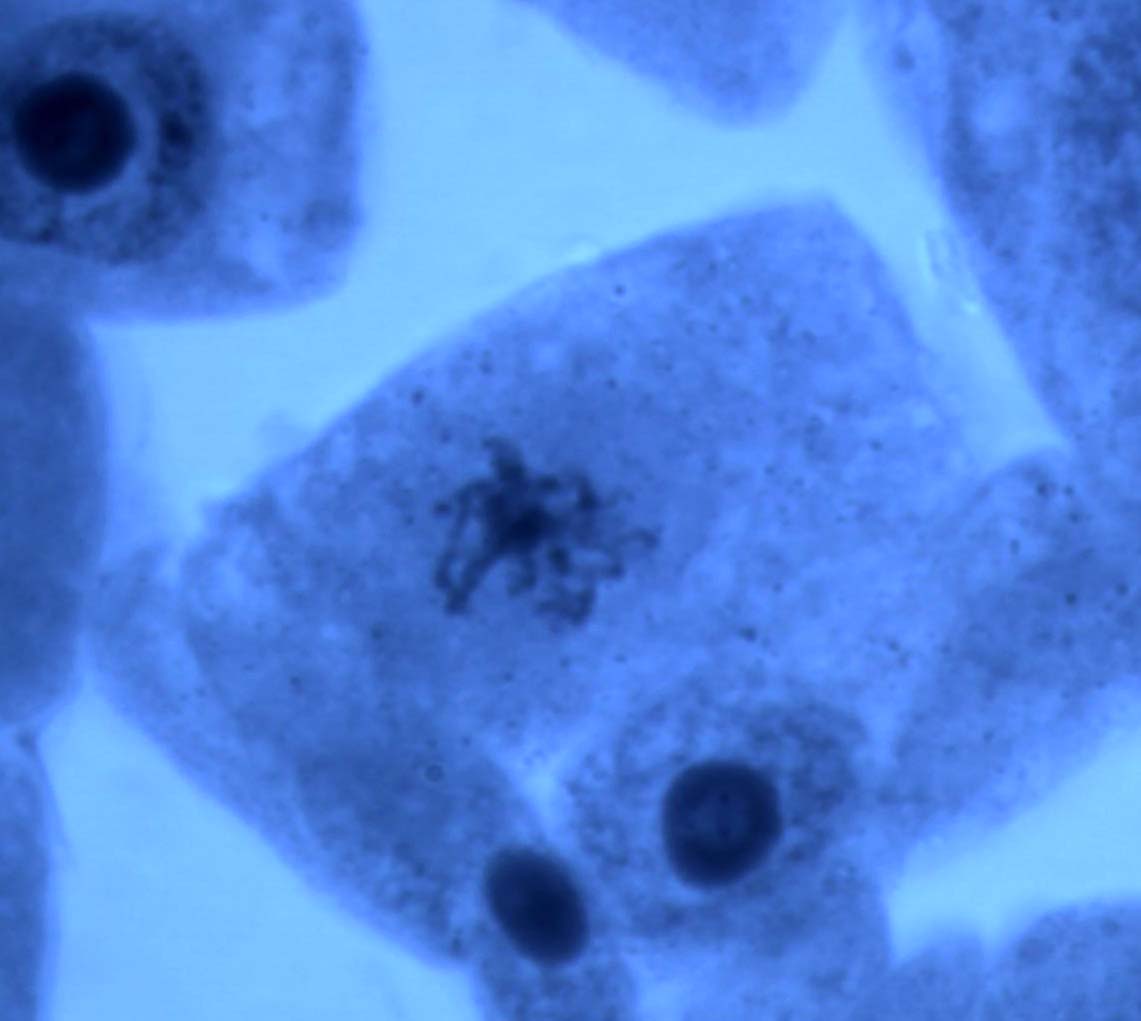
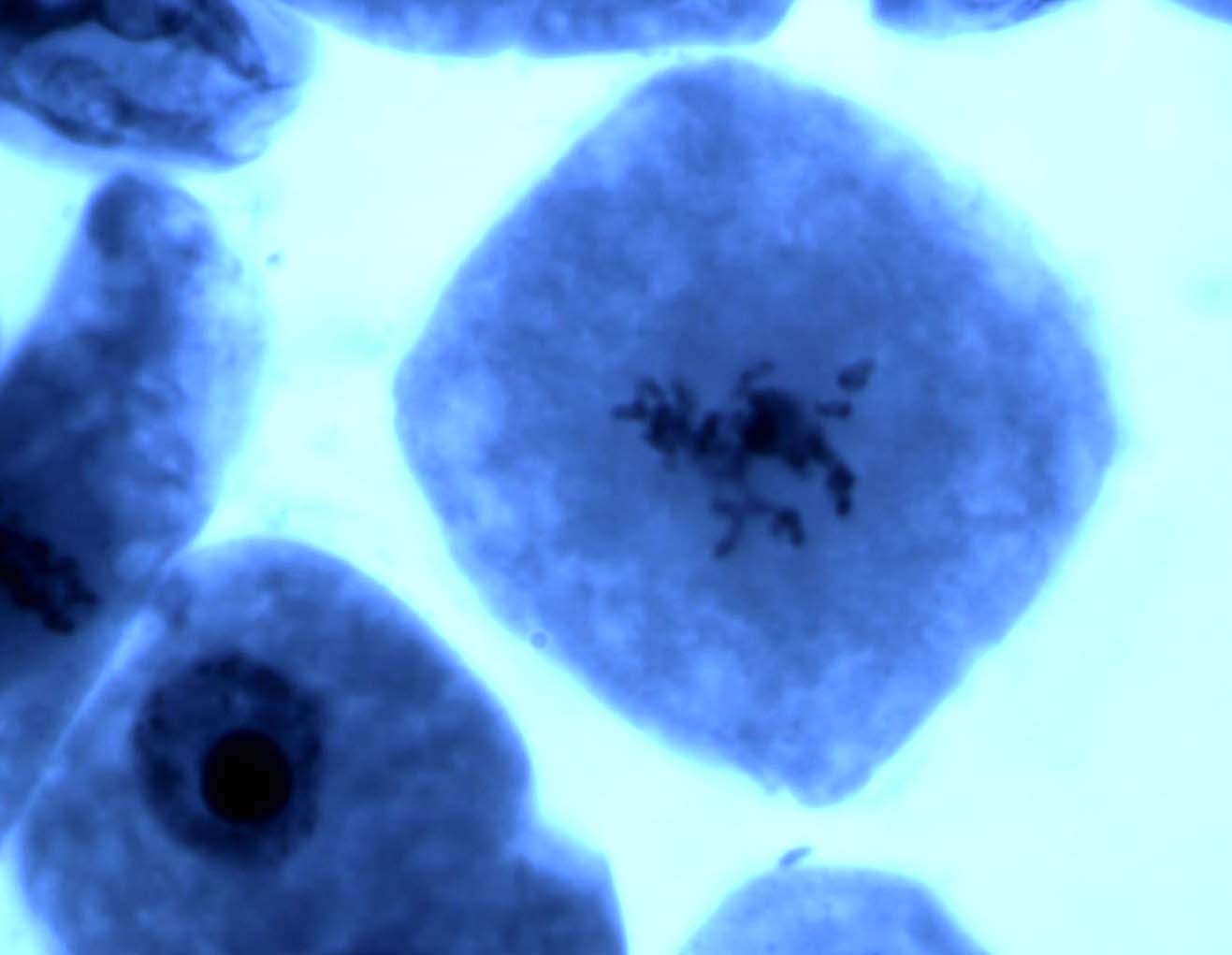
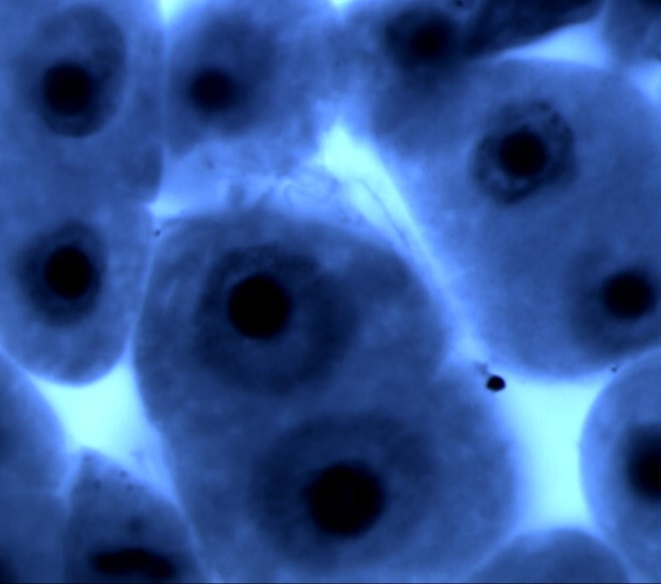
Типичными нарушениями митоза у ореха грецкого (табл. 2) являлись отставания хромосом в метакинезе и анафазе митоза, мосты в ана- и телофазе, а также агглютинации хромосом в метафазе. К числу редких патологий (1,6 %) относятся многополюсный и асимметричный митозы. У ореха грецкого не было выявлено каких-либо нарушений митоза, которые не встречались бы у других ранее изученных лиственных растений, произрастающих на территории Воронежской области. Фотографии некоторых патологий митоза представлены на рис. 1.
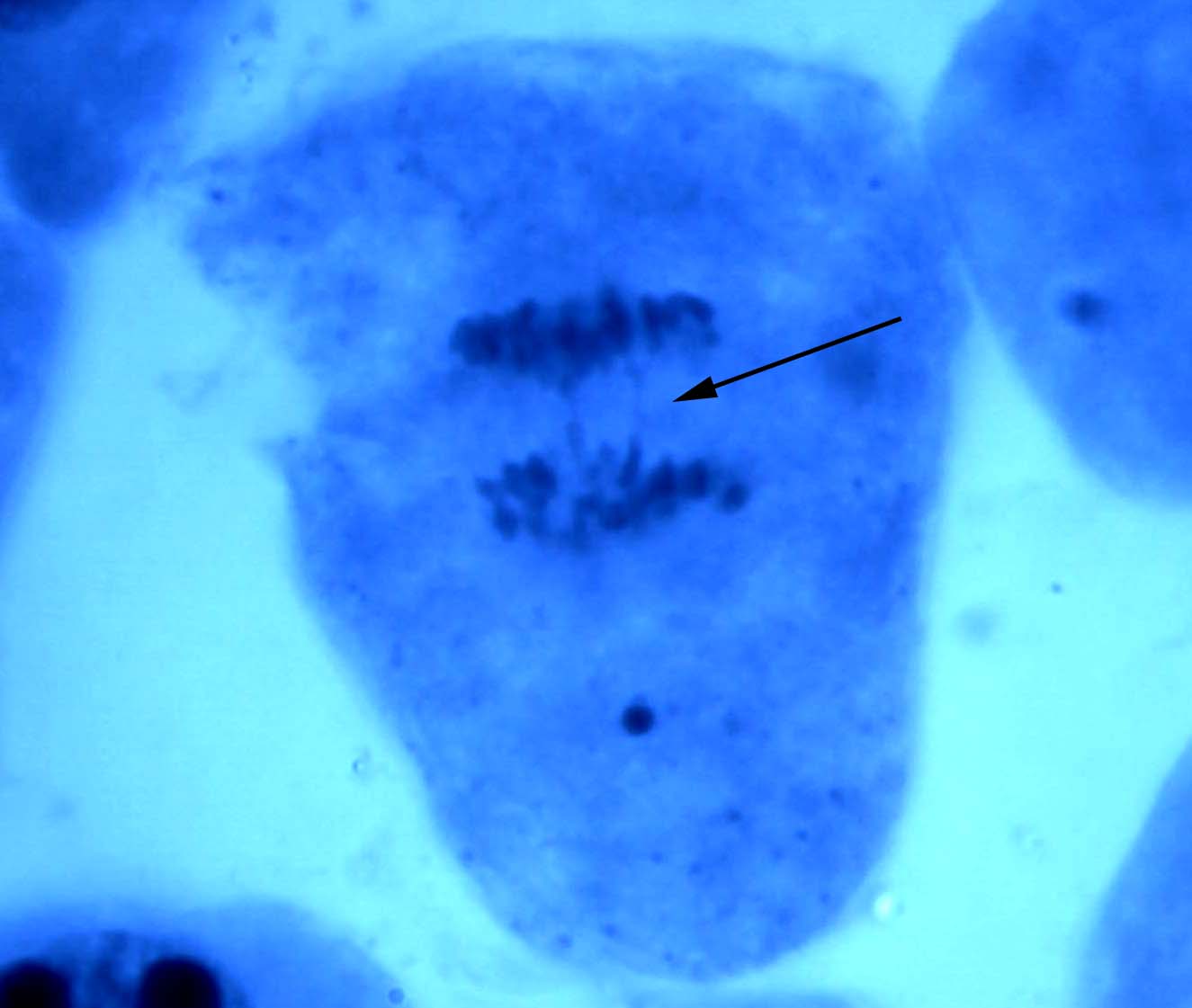
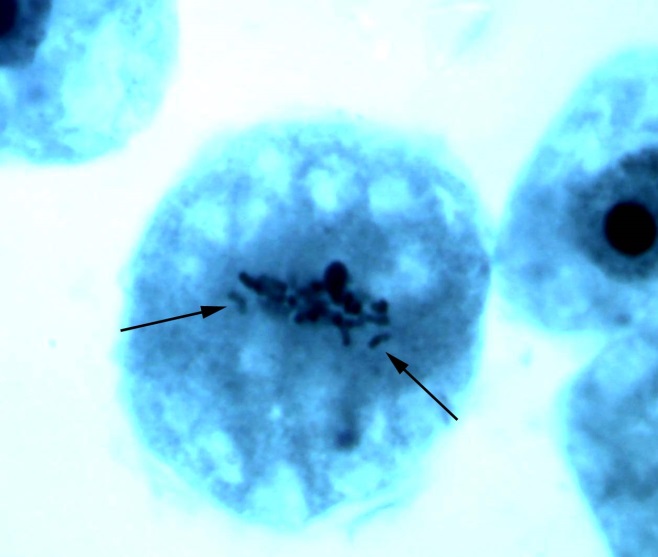
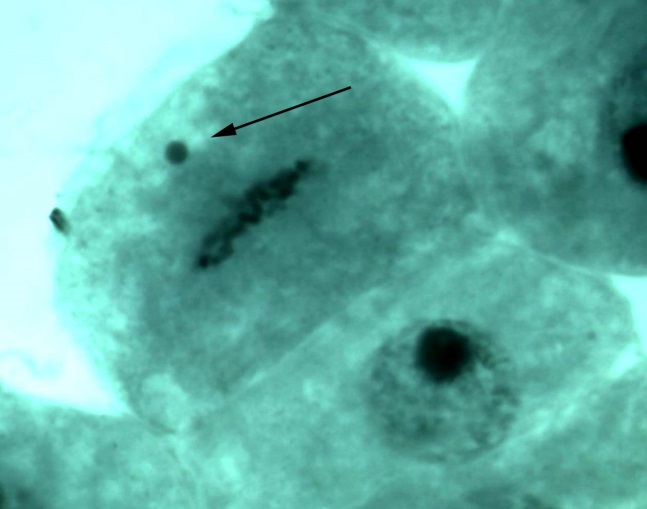
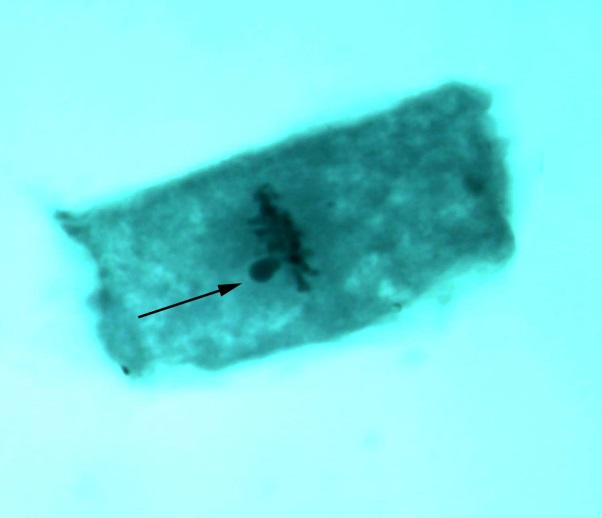
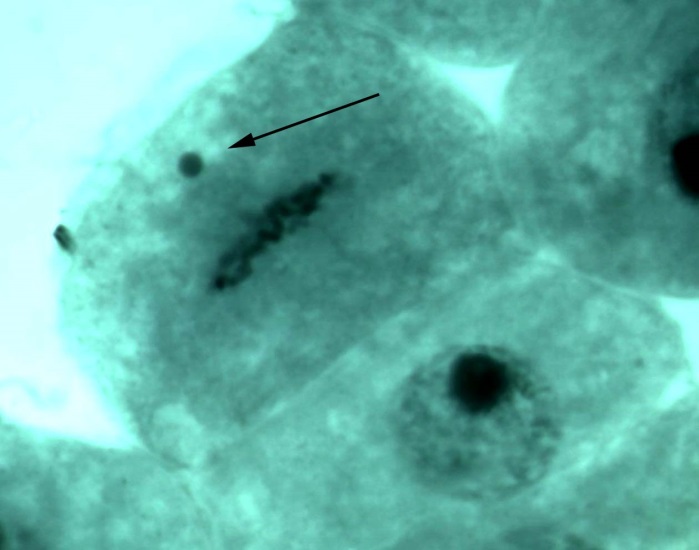
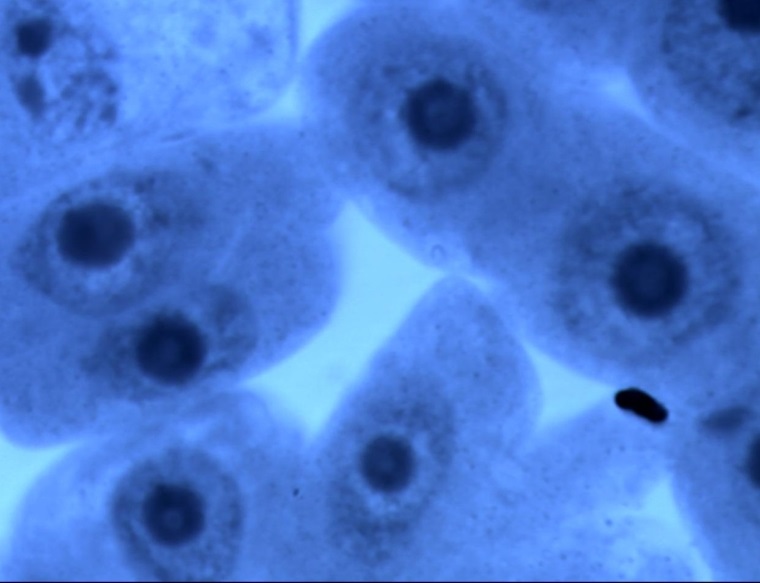
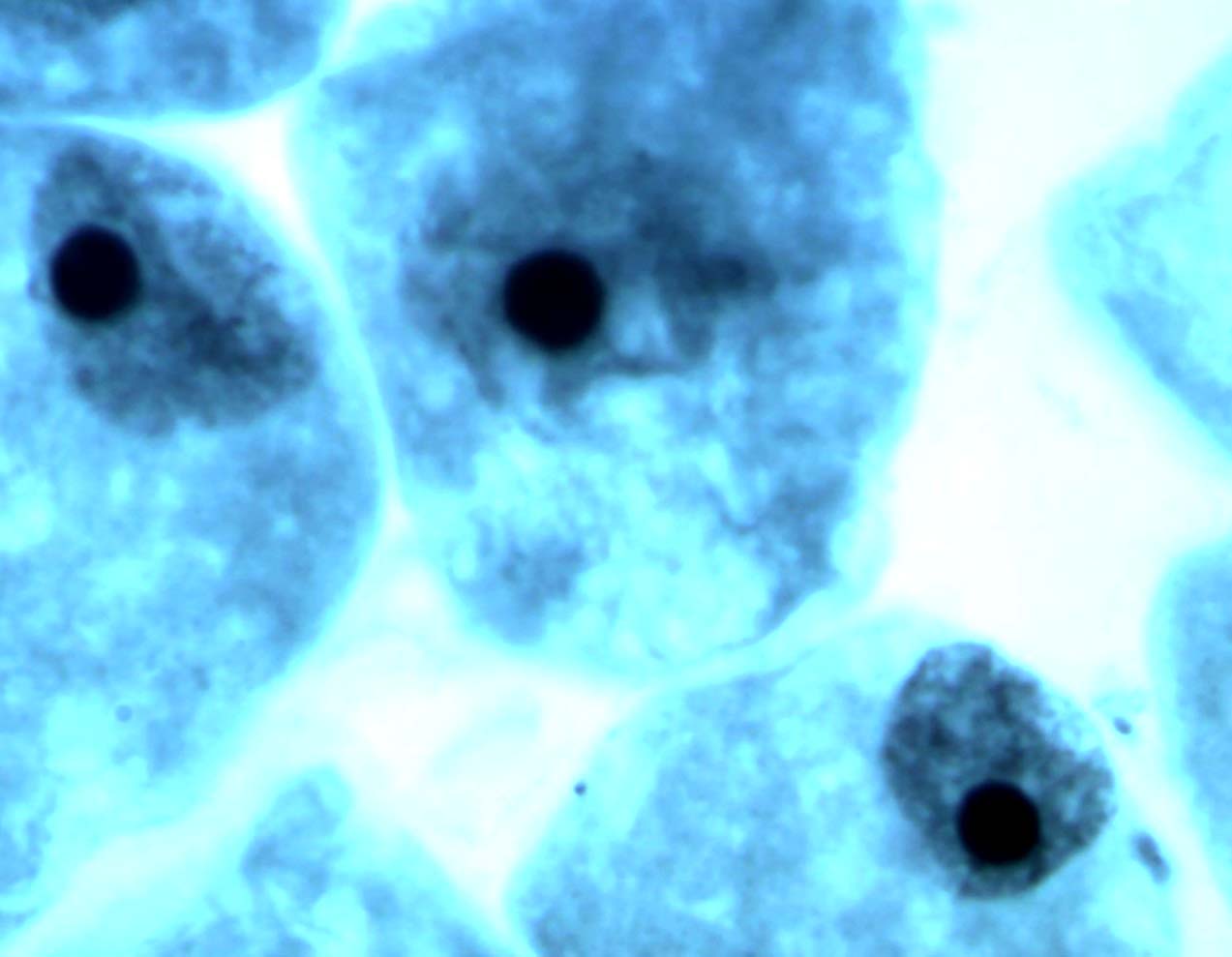
В меристеме проростков ореха грецкого обнаружено явление присутствия остаточного ядрышка на стадии метафазы, анафазы, телофазы (рис. 2). Остаточные ядрышки наблюдались в виде округлых образований по одну из сторон метафазной пластинки, отдельно от нее, либо соединенные с ней. В анафазе и телофазе остаточные ядрышки, как правило, оттесняются к одному из полюсов клетки. Появление остаточных ядрышек в делящихся клетках, вероятно, обусловлено компенсаторным синтезом белка, необходимым для поддержания нормального прохождения митоза [19]. Необходимо отметить, что данное функциональное нарушение – довольно редкое явление в клетках ореха грецкого по сравнению с другими изученными видами лиственных, что подтверждает предположение о стабильности протекания процессов клеточного деления в новых для вида природных условиях.
Таблица 2.
Спектр патологических митозов в корневой меристеме проростков ореха грецкого при интродукции на территории Воронежской области
|
Тип патологий |
Частота встречаемости патологии, % |
Пределы варьирования (95 %-ный доверительный интервал) |
|
Отставание хромосом в метакинезе |
37,2±4,1 |
от 29,2 до 46 |
|
Мост |
29,5±3,9 |
от 22,1 до 38,0 |
|
Отставание хромосом в анафазе |
21,7±3,5 |
от 15,3 до 29,7 |
|
Агглютинация |
10,1±2,6 |
от 5,9 до 16,6 |
|
Редкие патологии |
1,6±1,1 |
от 0,4 до 5,5 |
|
а |
б |
|
в |
г |
Рис. 1. Некоторые типы патологических митозов в клетках корневой меристемы проростков ореха грецкого (а – агглютинация хромосом в метафазе; б – мосты в анафазе; в – отставание хромосом в метакинезе; г – многополюсный митоз). Увеличение 100х1,5х10.
|
а |
б |
|
в |
г |
Рис. 2. Остаточные ядрышки на стадии метафазы (а, б), анафазы (в) и телофазы (г) митоза в клетках корневой меристемы деревьев ореха грецкого, произрастающих в условиях Воронежской области. Увеличение 100х1,5х10.
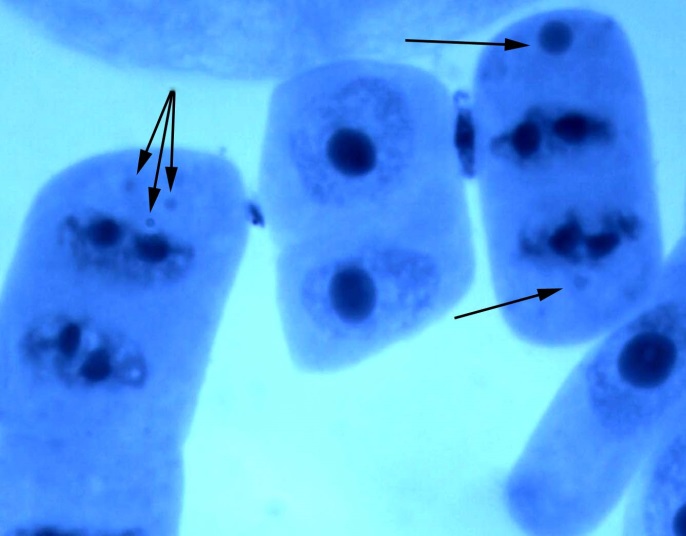
В меристеме проростков семян ореха грецкого отмечается высокая пластичность ядрышковых характеристик, проявляющаяся в изменении размеров, морфологии и количества ядрышек в ядре (табл. 1), что рассматривается рядом авторов в качестве главного признака при адаптации к неблагоприятным факторам среды [13, 21].
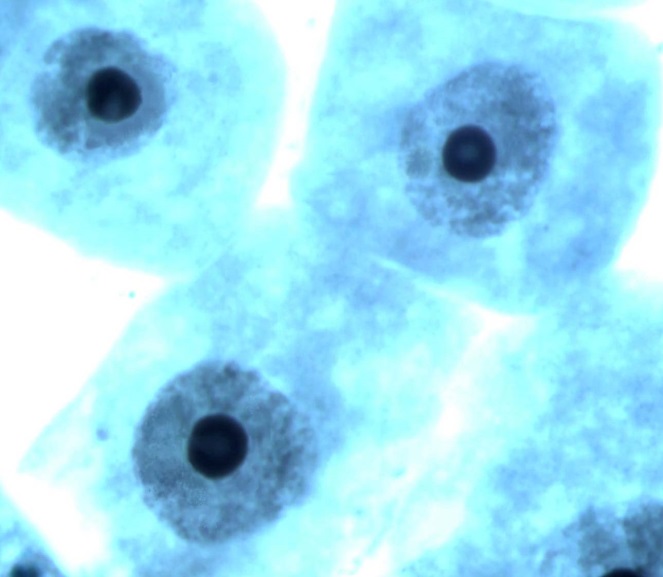
В интерфазных клетках проростков ореха грецкого наблюдались такие же типы ядрышек, как и у аборигенных видов древесных (дуб черешчатый, береза повислая). Фотографии обнаруженных в клетках ядрышек представлены на рис. 3.
Учитывая тот факт, что многие цитогенетические показатели семенного потомства ореха грецкого отличаются средними и высокими значениями коэффициента вариации (табл. 1), нами был проведен кластерный анализ данных, который позволил выявить наличие трех групп проростков.
Дендрограмма кластерных расстояний по изученным цитогенетическим характеристикам приведена на рис. 4. Дискриминантный анализ подтвердил правильность отнесения проростков к выделенным группам (P<0,01).
|
а |
б |
|
в |
г |
Рис. 3. Ядрышки различных типов в клетках корневой меристемы проростков ореха грецкого при интродукции в Воронежской области (а – «кора-сердцевина»,
б – «кора-сердцевина» с вакуолью, в – компактные, г – вакуолизированные). Увеличение 100х1,5х10.
Цитогенетические показатели семенного потомства ореха грецкого в выделенных группах проростков представлены в таблице 3.
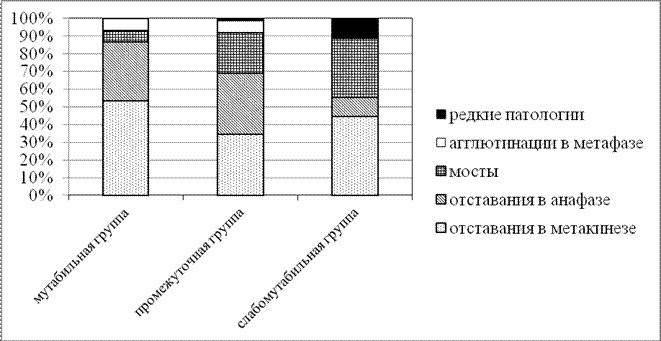
Основным критерием выделения указанных групп явился уровень патологических митозов, который зачастую обусловливает возникновение клеток с несбалансированными кариотипами, т.е. приводят к развитию мутаций и анеуплоидий. Поэтому, группу с высоким уровнем патологических митозов (13,7±3,6 %) возможно считать «мутабильной», а группу с минимальным уровнем аномальных митозов (1,3±0,4 %) – «слабомутабильной».
Одной из особенностей группы проростков с высоким уровнем цитогенетической нестабильности является низкий показатель митотической активности, при этом, как видно из таблицы 3, все выделенные группы проростков не различались между собой по показателю «митотический индекс без учета профазных клеток». Таким образом, снижение количества делящихся клеток в мутабильной группе проростков происходит за счет сокращения доли профаз. Ускоренное прохождение стадии профазы в этой группе проростков по сравнению с двумя другими позволяет выдвинуть предположение об имеющихся на этой стадии нарушениях процессов формирования веретена деления и/или процесса компактизации хромосом. Оба этих процесса и приводят к появлению высокого числа патологических митозов с преобладанием в спектре отставаний хромосом (86,6 %) (рис. 5).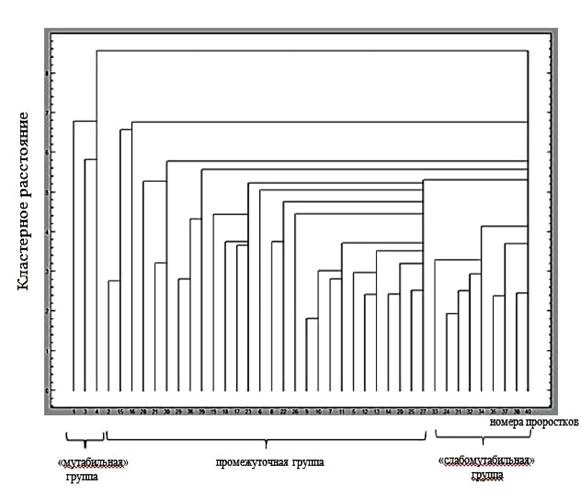
Рис. 4. Дендрограмма кластерных расстояний по цитогенетическим характеристикам между проростками семенного потомства деревьев ореха грецкого, произрастающих в Воронежской области.
В этой группе проростков обнаружены наибольшие количества клеток с остаточными ядрышками в митозе, что, возможно, свидетельствует об усилении активности рибосомальных генов в клетках меристемы в условиях недостаточного функционирования ядрышкового аппарата в интерфазе. Высокие показатели указанного критерия были обнаружены также при изучении полиморфизма по цитогенетическим показателям у проростков другого интродуцента – рододендрона Ледебура, относящихся к мутабильной группе. Данный феномен рассматривается как частый случай усиления ядрышковой активности и является адаптационным механизмом, обеспечивающим приспособление организма к неблагоприятным условиям среды [19, 26].
Таблица 3.
Цитогенетические характеристики различных по мутабильности групп проростков ореха грецкого при интродукции на территории Воронежской области
|
Цитогенетические показатели |
Мутабильная |
Промежуточная |
Слабо-мутабильная |
|
Количество проростков в группе, шт. |
3 |
28 |
9 |
|
Митотический индекс, % |
3,7±0,9а,б |
5,7±0,4 |
6,7±0,7 |
|
Митотический индекс без учета профазных клеток, % |
3,0±0,8 |
4,0±0,3 |
3,3±0,5 |
|
Доля клеток на стадии профазы, % |
19,1±2,9а, б |
31,1±2,6 |
50,5±3,8б |
|
Доля клеток на стадии метафазы, % |
35,9±6,0а, б |
17,8±1,2 |
13,3±2,1 |
|
Доля клеток на стадии анафазы-телофазы, % |
45,0±6,8 |
51,8±1,9 |
36,2±3,1б |
|
Уровень патологических митозов, % |
13,7±3,6а, б |
6,7±0,8 |
1,3±0,4б |
|
Уровень патологических митозов без учета профазных клеток, % |
17,3±5,0а, б |
10,2±1,2 |
3,0±1,0б |
|
Частота встречаемости клеток с остаточными ядрышками, % |
0,9 ±0,9 |
0,7±0,3 |
0,3±0,3 |
|
Площадь поверхности ядрышек, мкм2 |
|
|
|
|
Площадь поверхности ядрышек в клетках с 1 ядрышком в ядре, мкм2 |
77,6 ±4,9б |
88,4±2,4 |
78,9±2,8б |
|
Площади поверхности ядрышек типа «кора-сердцевина» с вакуолью, мкм2 |
97,2±12,2 |
107,6±3,6 |
88,9±3,4б |
|
Площади поверхности ядрышек типа «кора-сердцевина», мкм2 |
77,5±3,0 |
83,3±2,1 |
75,2±2,5б |
|
Площади поверхности вакуолизированных ядрышек, мкм2 |
73,3±3,0 |
— |
— |
|
Площади поверхности компактных ядрышек, мкм2 |
47,6±4,0 |
15,8±3,6 |
— |
|
Доля ядрышек, % |
|
|
|
|
Частота встречаемости ядрышек типа «кора-сердцевина» с вакуолью, % |
28,8±4,4 |
30,1±4,0 |
30,9±4,7 |
|
Частота встречаемости ядрышек типа «кора-сердцевина», % |
45,9±3,9а, б |
68,1±3,7 |
69,1±4,7 |
|
Частота встречаемости вакуолизированных ядрышек, % |
2,4±0,7 |
— |
— |
|
Частота встречаемости компактных ядрышек, % |
22,9±10,0б |
1,8±0,7 |
— |
|
Доля интерфазных клеток, имеющих клетки с 2 ядрышками в ядре, % |
2,2±0,4а |
2,0±0,2 |
3,1±0,5б |
Примечания: а различия со слабомутабильной группой достоверны (P<0,05);
б различия с промежуточной группой достоверны (P<0,05).
Рис. 5. Спектр патологических митозов в различных по мутабильности группах проростков ореха грецкого.
В мутабильной группе проростков имеется весь спектр описанных для проростков ореха грецкого типов ядрышек. Только в этой группе проростков встречались вакуолизированные ядрышки с низким уровнем синтетической активности, а доля высокоактивных ядрышек типа кора-сердцевина имела наименьшие по сравнению с другими группами значения. Это, по-видимому, свидетельствует о недостаточном уровне ядрышковой активности в интерфазных клетках. Поэтому расширение спектра типов ядрышек в данной группе за счет увеличения доли компактных ядрышек с максимальной синтетической активностью можно рассматривать в качестве компенсаторного механизма, восполняющего недостаточную метаболическую активность в меристеме данной группы проростков.
В слабомутабильной группе проростков отмечается повышенное количество клеток на стадии профазы, что, по-видимому, связано с прохождением точек чекпойнт-репарации, приводящих к сокращению доли аномальных клеточных делений [14]. Кроме того, увеличение числа делящихся клеток в данной группе проростков можно рассматривать как компенсаторный механизм, обеспечивающий большую устойчивость проростков, так как именно объем меристем определяет качественные и количественные характеристики развития целого организма [27].
В группе проростков с низким уровнем цитогенетических нарушений отмечается отрицательная корреляционная связь между частотой встречаемости патологических митозов и частотой встречаемости клеток с остаточными ядрышками на стадии метафазы-телофазы митоза (rS = –0,36, P<0,05). Она свидетельствует о компенсаторной роли остаточных ядрышек в митозе, которая заключается в поддержании синтеза необходимых клетке белков в стрессовых условиях (условиях интродукции) и тем самым, возможно, ведет к снижению частоты встречаемости патологий митоза.
Как показывает анализ рисунка 5, в спектре патологических митозов в слабомутабильной группе проростков увеличена доля мостов, по сравнению с другими группами, что свидетельствует об усилении репаративных процессов в этой группе проростков [28].
Для данной группы проростков характерно отсутствие компактных и вакуолизированных ядрышек в интерфазных клетках, однако количество клеток с двумя ядрышками в ядре максимально по сравнению с другими группами проростков. Наибольшие доли интерфазных клеток с двумя и более ядрышками в ядре при изучении цитогенетического полиморфизма отмечались также в слабомутабильной группе проростков деревьев березы повислой, произрастающих в естественных и искусственных древостоях Центрального Черноземья. Увеличение числа двуядрышковых и многоядрышковых интерфазных клеток отражает механизмы поддержания синтетической активности на стабильном уровне в меристеме проростков слабомутабильной группы [17].
Необходимо также отметить, что мутабильная группа составила всего 7,5 % от общего количества проанализированных проростков. На долю слабомутабильной группы пришлось 22,5 %. Промежуточная группа включала 70 % от всех изученных проростков и характеризовалась переходными между слабомутабильной и мутабильной группами проростков значениями цитогенетических показателей (табл. 3). Полученные данные о размерах выделенных групп свидетельствует о высокой степени адаптации материнских деревьев ореха грецкого к природно-климатическим условиям Воронежской области при интродукции, что позволяет им продуцировать семенное потомство с низким уровнем повреждений генетического материала.
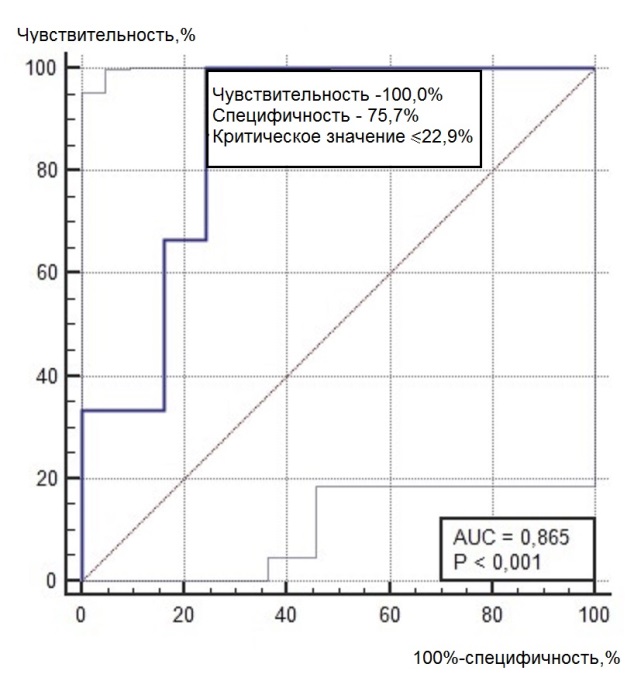
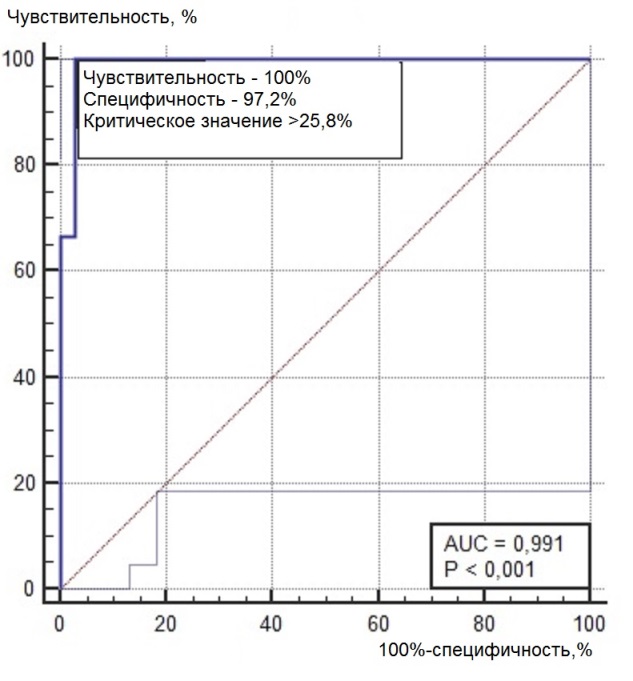
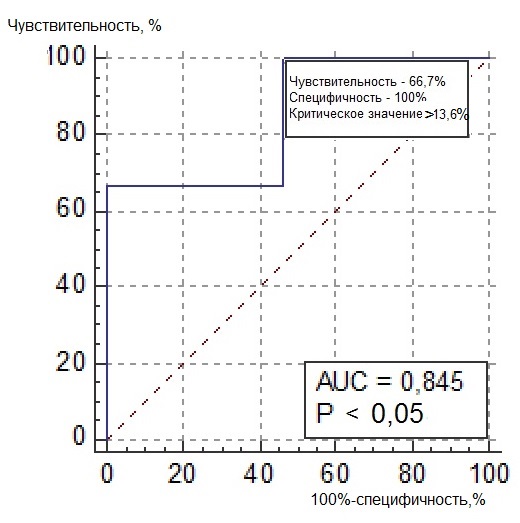
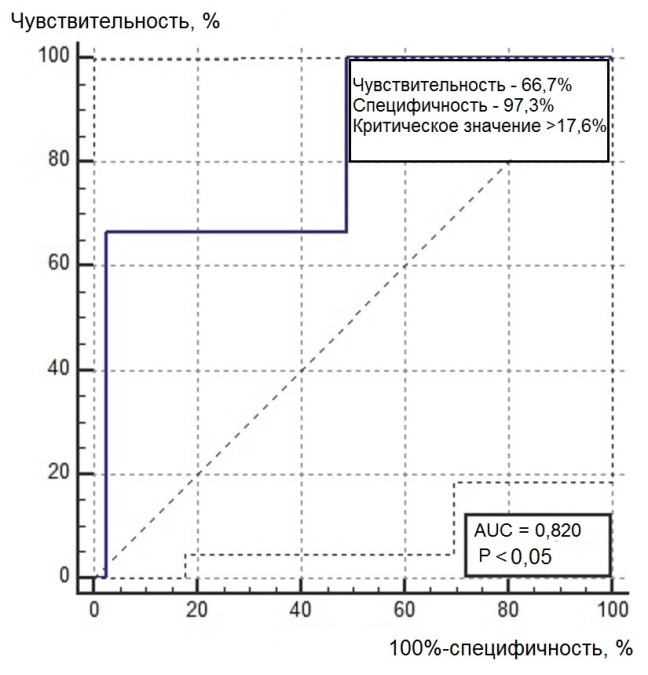
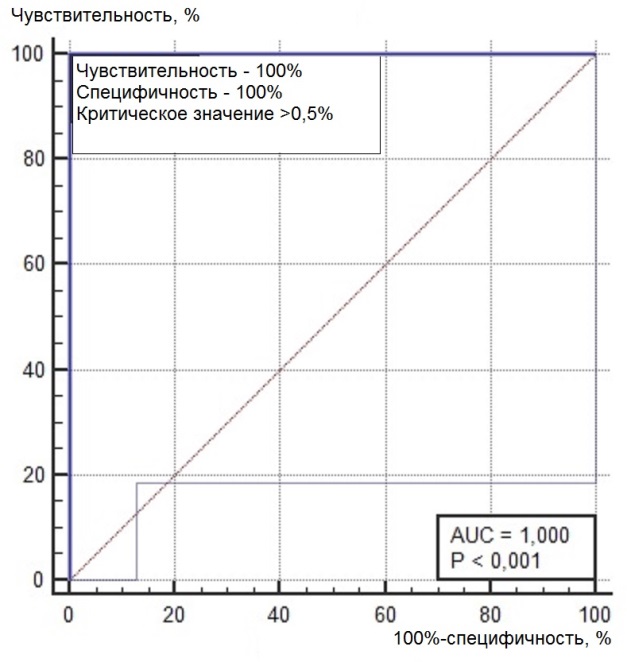
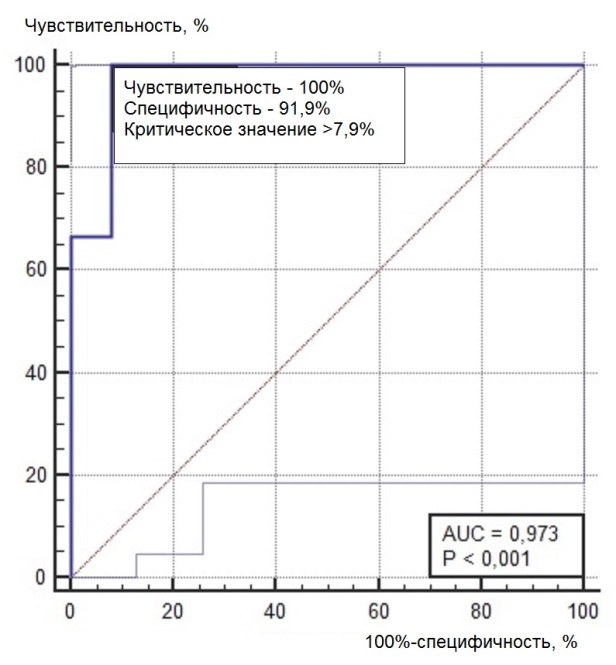
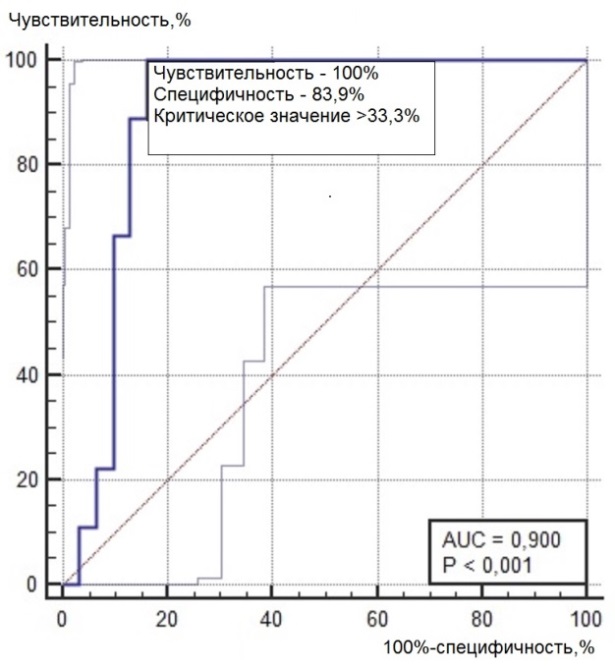
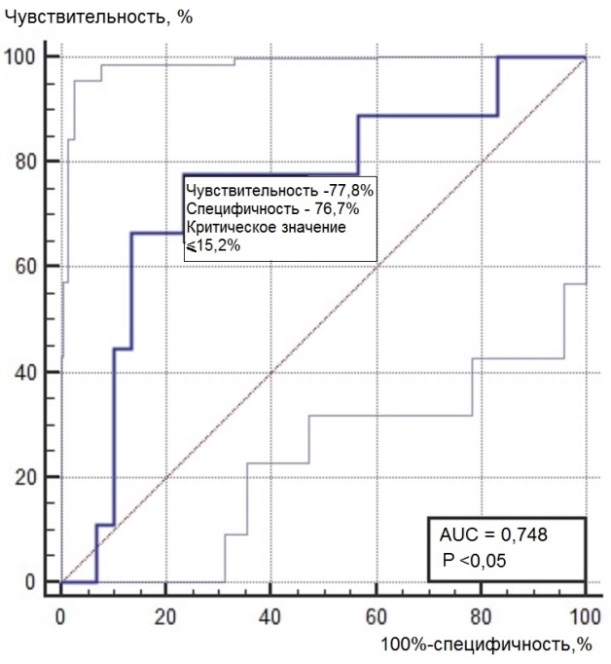
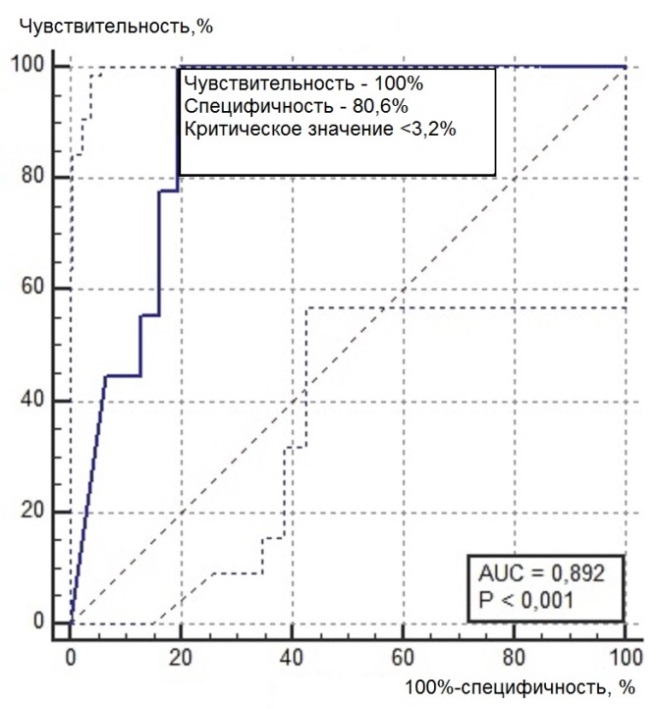
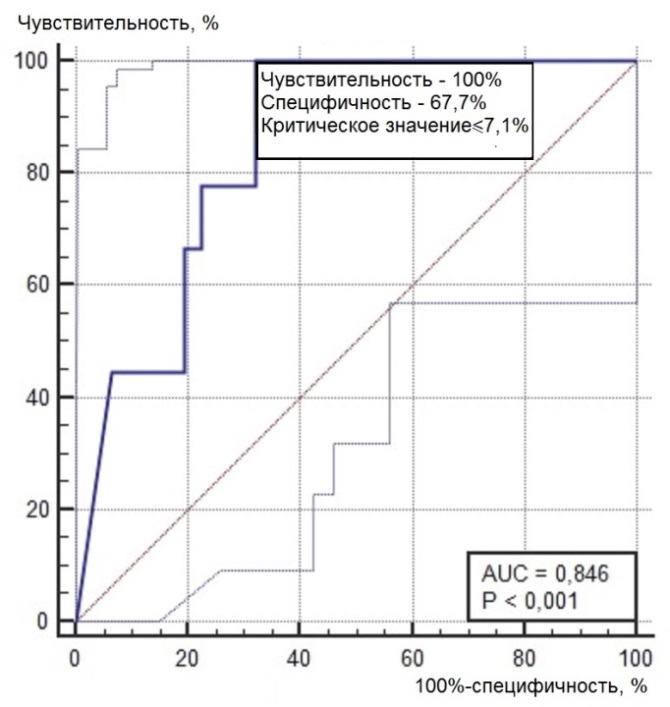
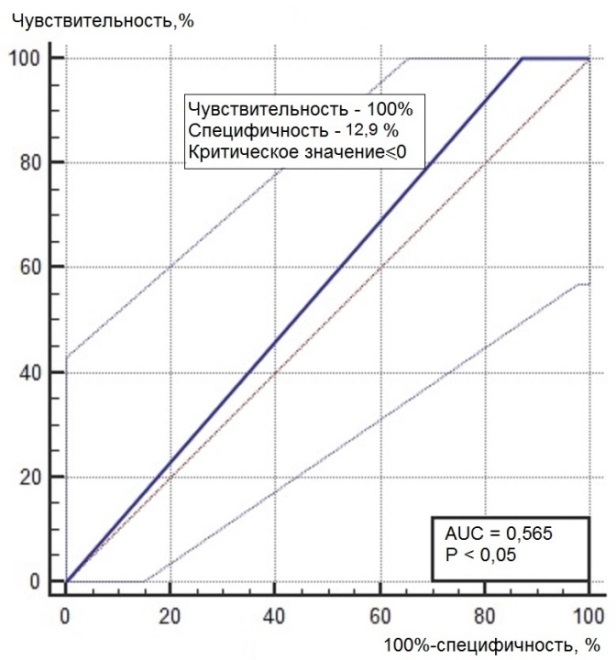
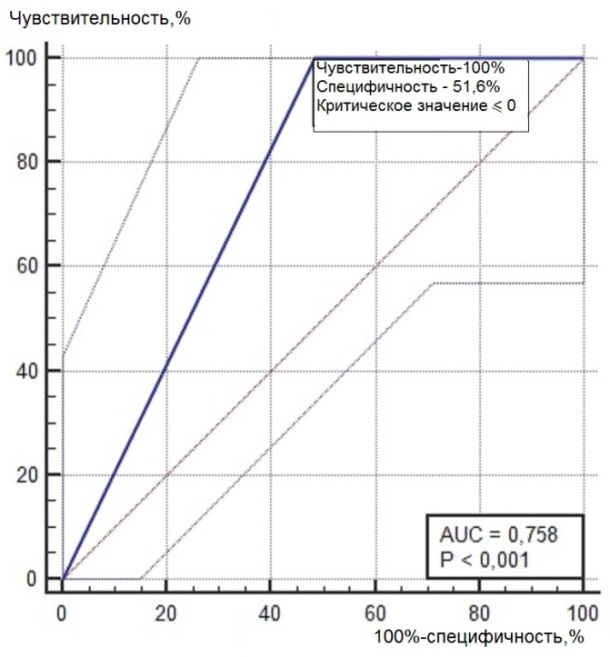
Нами был проведен ROC-анализ цитогенетических показателей семенного потомства ореха грецкого с целью выявления критических значений (точек отсечения значений изучаемых показателей), позволяющих определять принадлежность любого исследованного проростка к одной из выделенных модельных (мутабильной и слабомутабильной) групп проростков. В качестве предикторов к мутабильной или слабомутабильной группы были использованы цитогенетические критерии, для которых диагностическая ценность была подтверждена, показавшие диагностическую способность в обеих выделенных группах проростков. Такими предикторами можно считать доли клеток на стадии профазы и метафазы, уровень патологических митозов (как с учетом, так и без учета профазных клеток), частоты встречаемости интерфазных клеток с компактными и вакуолизированными ядрышками. ROC-кривые предикторов отнесения представлены на рис. 6, 7. Как видно из анализа рисунков, практически все указанные цитогенетические показатели проявили себя как предикторы с хорошей и отличной диагностической ценностью показателя при высоких значениях чувствительности и специфичности каждого критерия.
|
а |
б |
|
в |
г |
|
д |
е |
Рис. 6. ROC-кривые предикторов отнесения проростков к мутабильной группе проростков: а – для показателя «доля клеток на стадии профазы, %»; б – для показателя «доля клеток на стадии метафазы, %»; в – для показателя «уровень патологических митозов с учетом профаз, %»; г – для показателя «уровень патологических митозов без учета профаз, %»; д – для показателя «частота встречаемости вакуолизированных ядрышек, %»; е – для показателя «частота встречаемости компактных ядрышек, %».
|
а |
б |
|
в |
г |
|
д |
е |
Рис. 7. ROC-кривые предикторов отнесения проростков к слабомутабильной группе проростков: а – для показателя «доля клеток на стадии профазы, %»; б – для показателя «доля клеток на стадии метафазы, %»; в – для показателя «уровень патологических митозов с учетом профаз, %»; г – для показателя «уровень патологических митозов без учета профаз, %»; д – для показателя «частота встречаемости вакуолизированных ядрышек, %»; е – для показателя «частота встречаемости компактных ядрышек, %».
Опираясь на данные ROC-анализа, можно определить параметры состояния цитогенетического аппарата проростков ореха грецкого, по которым их можно отнести к одной из выделенных групп – мутабильной или слабомутабильной с максимальной вероятностью. Значения цитогенетических показателей (дискриминаторов) для каждой из групп представлены в табл. 4. Так, к мутабильной группе проростков можно будет отнести такие, у которых в корневой меристеме будет выявлено менее 22,9 % профазных клеток и превышение по остальным представленным в таблице 4 показателям. К слабомутабильной группе, наоборот, можно будет отнести проростки, не имеющие в интерфазных ядрах компактных и вакуолизированных типов ядрышек, с низким уровнем патологий митоза, повышенной долей профаз в митозе (более 33,3 %) и низкой долей метафаз (менее 15,2 %). Определение значений указанных предикторов позволит существенно снизить трудозатраты цитологов при определении качества продуцируемого семенного потомства материнскими деревьями ореха грецкого, произрастающих в новых для данного вида экологических условиях. В то же время, определение качественного и количественного полиморфизма семенного потомства может свидетельствовать о степени адаптации материнских деревьев к условиям интродукции.
Таблица 4
Значения цитогенетических показателей – дискриминаторов отнесения проростков к мутабильной или слабомутабильной группе (%)
|
Показатели |
Мутабильная группа проростков |
Слабомутабильная группа проростков |
|
Доля клеток на стадии профазы |
≤22,9 |
> 33,3 |
|
Доля клеток на стадии метафазы |
> 25,8 |
≤ 15,2 |
|
Уровень патологических митозов с учетом профаз |
> 13,6 |
≤3,2 |
|
Уровень патологических митозов без учета профаз |
> 17,7 |
≤7,1 |
|
Частота встречаемости вакуолизированных ядрышек |
> 0,5 |
≤0 |
|
Частота встречаемости компактных ядрышек |
> 7,9 |
≤0 |
ЗАКЛЮЧЕНИЕ
Таким образом, опираясь на описанные выше цитогенетические показатели проростков ореха грецкого, можно сделать вывод о преимущественно стабильном протекании митоза, что свидетельствует о высокой степени адаптации материнских деревьев интродуцента – ореха грецкого к экологическим условиям Воронежской области. Полученные данные о качественном и количественном полиморфизме цитогенетических характеристик, а также определение цитогенетических критериев принадлежности проростков к выделенным полиморфным группам, могут быть использованы для разработки рекомендаций по отбору мутабильного и слабомутабильного семенного потомства для лесной селекции.
REFERENCES
- Biganova S. G., Sukhorukikh Yu. I., Lugovskoy A. P. Modern trends in the selection of walnut in Russia, Modern problems of science and education, 2, 531 (2015).
- Ibragimov Z. A. Genetic centers of Juglans regia origin and world nuts production, Agrarian science, 7, 17 (2010).
- Kornienko P. S., Potanin D. V. Prospects for growing walnut in the Republic of Crimea and Russia. Science yesterday, today, tomorrow: Sat. Art. by mater. XLII int. scientific-practical conf. (Novosibirsk: SibAK, 2017), 77.
- Vasin E. A. Selection and evaluation of promising walnut forms for central Russia: author. dis. … cand. s-x. sciences (SPb, 2004), p. 20.
- Veresin M. M., Ulyukina M. K. Breeding of walnut for winter hardiness by the method of selection and hybridization: Forest genetics, selection and seed production (Petrozavodsk, 1970), 365.
- Nikolaev E. A., Slavsky V. A., Tishchenko V. V. Introduction and breeding of walnut in the Voronezh region (Voronezh: publishing house of Voronezh State University, 2007), p. 152
- Pomogaybin A. V. Ecological and biological analysis of the results of introduction tests of species of the genus walnut (Juglans L.) in the forest-steppe of the Middle Volga region: author. dis. … cand. biol. Sciences (Togliatti, 2008), p.16.
- Slavsky V. A., Timashchuk D. A., Mironenko A. V. Zoning of Juglans regia in the Voronezh region in the zones of resistance to adverse factors, Forestry journal, 7 (3), 143 (2017).
- Butorina A. K. Method of preliminary genetic assessment of selected plus trees for the creation of clonal and seed plantations: Forestry information recommended for implementation (M.: VNIITs Lesresurs, 1989), 8, 8.
- Zoldos V., Besendorfer V., Jelenic S. [et al.] Cytogenetic damages as an indicator of pedunculate oak forest decline: Cytogenetic studies of forest trees and shrub species (Zagreb, 1997), 275.
- Kalaev V. N., Popova A. A. Cytogenetic polymorphism of seed progeny of english oak trees (Quercus robur) from the territories with different levels of anthropogenic pollution, Problems of regional ecology, 2, 176 (2014).
- Karpova S. S. Cytogenetic variability of seed progeny of birch (Betula pendula Roth) in natural stands of Khrenovskoy forest, Bulletin of the Voronezh State University. Series: Chemistry. Biology. Pharmacy, 2, 85 (2010).
- Vostrikova T. V., Butorina A. K. Cytogenetic responses of birch to stress factors, Biology bulletin, 33 (2), 185 (2006).
- Kalaev V. N. Cytogenetic reactions of deciduous woody plants to stress conditions and prospects for their use to assess the genotoxicity of the environment: diss. … doct. biol. sciences (Voronezh, 2009), p. 414
- Kalaev V. N., Popova A. A. Cytogenetic characteristics and morphological parameters of english oak seed progeny oak (Quercus robur), growing in territories with different levels of anthropogenic pollution, Bulletin of Voronezh State University. Chemistry series. Biology. Pharmacy, 4, 63 (2014).
- Butorina A. K., Kalaev V. N., Vostrikova T. V., Myagkova O. E. Cytogenetic characteristics of seed progeny of some species of woody plants in conditions of anthropogenic pollution of Voronezh, Tsitologiya, 42 (2), 196 (2000).
- Kalaev V. N., Karpova S. S., Artyukhov V. G. Cytogenetic characteristics of weeping birch (Betula pendula Roth) seed progeny in different ecological conditions, Bioremediation, Biodiversity and Bioavailability, 4 (S1), 77 (2010).
- Kalaev V. N., Butorina A. K. Cytogenetic effect of radiation in seed of oak (Quercus robur) trees growing on sites contaminated by Chernobyl fallout, Silvae Genetica, 55 (3), 93 (2006).
- Burmenko Yu. V., Baranova T. V., Kalaev V. N., Sorokopudov V. N. Cytogenetic polymorphism of seed progeny of introduced plants on the example of Rhododendron ledebourii, Turczaninowia, 21 (1), 164 (2018).
- Alov I. A. Cytophysiology and pathology of mitosis (M.: Medicine, 1972), p. 264.
- Chelidze V. P., Zatsepina O. V. Morphofunctional classification of nucleoli, Advances in modern biology, 105 (2), 252 (1988).
- Kalaeva E. A., Artyukhov V. G., Kalaev V. N. Theoretical foundations and practical application of mathematical statistics in biological research and education: textbook (Voronezh: Voronezh State University Publishing House, 2016), p. 282
- Lakin G. F. Biometrics (M .: Higher school, 1990), p. 352
- Grigoriev S. G., Lobzin Yu. V., Skripchenko N. V. The role and place of logistic regression and ROC analysis in solving medical diagnostic task, Journal of Infectology, 8 (4), 36 (2016).
- Nazarova M. N., Nekrylova E. A., Zhivotiagina M. V. Features of mitosis in species of the genus Catalpa Scop. during introduction in the conditions of Voronezh, Cytology, 12, 1072 (1999).
- Butorina A. K., Kosichenko N. E., Isakov Y. N. [et al.] The effects of irradiation from the Chernobyl nuclear power plant accident on the cytogenetic behavior and anatomy of trees: Cytogenetic studies of forest trees and shrub species (Zagreb, 1997), p. 211.
- Kosulina L. G. Physiology of plant resistance to unfavorable environmental factors (Rostov-on-Don: Rostov University Publishing House, 1993), p. 240
- Simakov E. A. On post-radiation restoration of cytogenetic damage in seedlings of seeds of different forms of potato, Radiobiology, 23 (5), 703 (1983).