INFLUENCE OF LOW-INTENSITY ELECTROMAGNETIC RADIATION OF THE MILLIMETER RANGE ON THE PIGMENTAL COMPOSITION AND PHOTOSYNTHETIC ACTIVITY OF TRITICUM AESTIVUM L. UNDER CHLORIDE SALINATION
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №3, 2021
Publication text (PDF):Download
UDK: 612.014.42
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Chmeleva S. I., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Dzheldubaeva E. R., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Tumanyants K. N., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-3-262-270
PAGES:from 262 to 270
STATUS:Published
LANGUAGE:Russian
KEYWORDS: millimeter-range low-intensity electromagnetic radiation, osmotic stress, pigments, chlorophyll, photosynthetic activity, Triticum aestivum L.
ABSTRACT (ENGLISH):
The purpose of this research was to study the effect of low-intensity electromagnetic radiation (EMP) of the millimeter (mm) range (wavelength – 7.1 mm, radiation frequency – 42.3 GHz, radiation power flux density – 0.1 mW / cm2, exposure 30 minutes, once) on the pigment composition and photosynthetic activity of juvenile plants of Triticum aestivum L., cultivar Selyanka, under osmotic stress caused by chloride salinity.
To measure the intensity of photosynthesis, we used the assimilation flask method according to L. A. Ivanov and N. L. Kossovich, a colorimetric method was used to determine the amount of chlorophyll in wheat plants. Statistical processing of the data obtained was carried out using the Kruskell-Walliss test of reliability. All measurements and studies were carried out on equipment that passed metrological verification and expertise.
The results of the study indicate that under the influence of low-intensity EMR of the MM range, the indicators of the amount of chlorophylls increase by 51.8 % compared to plants under osmotic stress; and compared with the control, the accumulation of chlorophyll increases by 23.2 %. In addition, the effect of this physical factor has a stimulating effect on the accumulation of chlorophyll and its content was 30.9 %, which is 46.6 % more than in the control variant.
The stimulating effect of EMR is also observed at a concentration of 150 mM sodium chloride. With the use of EHF-radiation, the content of chlorophyll was 28.2 % of the mass of raw leaves, by 43.3 % compared to the experimental versions without the use of EHF-radiation.
The intensity of photosynthesis under the influence of EHF-radiation increases in relation to the control by 14.0 %.
Thus, a positive effect of low-intensity EMM of the mm range on the pigment composition and photosynthetic activity of Triticum aestivum L. both under optimal conditions and under conditions of osmotic stress has been established. The results obtained on the quantitative content of chlorophylls showed that their content increased both under normal conditions and under osmotic stress by an average of 20 %. An increase in the intensity of photosynthesis in experimental plants was established by 30.0 % in comparison with control plants under osmotic stress.
ВВЕДЕНИЕ
На современном этапе интенсификации различных отраслей растениеводства необходимо применять современные методы воздействия на растения для повышения устойчивости высокопродуктивных сортов злаковых культур к неблагоприятным условиям произрастания таким, как пониженная и повышенная температура, недостаток влаги, засоление почвы.
Засоление почвы – критический фактор, лимитирующий процессы роста и развития растений [1, 2]. В условиях хлоридного засоления почвы тормозится клеточное деление и растяжение, что приводит к формированию мелких клеток. Вследствие этого задерживается рост самого растения, в первую очередь листьев и стеблей. Таким образом, засоленность почв вызывает значительные и постепенно усиливающиеся изменения большинства физиологических процессов в организме растений [3, 4].
Для ослабления отрицательных влияний осмотического стресса в сельскохозяйственной практике используют различные приемы, но они не всегда бывают эффективными в плане продуктивности и качества, а также экономической целесообразности. В ряде работ было показано положительное влияние обработки растений синтетическими регуляторами роста, микроэлементами, биологически активными веществами, витаминами [5–7].
Перспективным и экологически безопасным техническим приёмом предпосевной обработки семян сельскохозяйственных культур является, превентивная обработка семян культурных растений электромагнитным излучением (ЭМИ) низкой интенсивности. Низкоинтенсивное ЭМИ миллиметрового (ММ) диапазона с одной стороны, является одной из составляющих электромагнитного загрязнения, а с другой, как показали результаты проведенных до настоящего времени исследований, – одним из механизмов регулирования процессов жизнедеятельности [8–10].
В литературе опубликовано достаточно много исследований, посвященных изучению механизмов адаптации растений к хлоридному стрессу под влиянием стимуляторов роста. Но данные по применению низкоинтенсивного ЭМИ ММ диапазона с целью повышения солеустойчивости растений и изучению его действия на физиолого-биохимические процессы пшеницы при таких условиях нами не обнаружено.
Целью наших исследований являлось изучение влияния низкоинтенсивного электромагнитного излучения миллиметрового диапазона на пигментный состав и фотосинтетическую активность Triticum aestivum L. в условиях хлоридного засоления.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования явились семена и растения Triticum aestivum L., сорт Селянка. Семена данного растения отбирали по средним размерам, подвергали воздействию низкоинтенсивного ЭМИ ММ диапазона и замачивали на 30 минут в растворе перикиси водорода для дезинфекции. Контролем служили необлученные ЭМИ ММ семена.
Для экспериментального облучения использовали терапевтические генераторы «КВЧ. РАМЕД-ЭКСПЕРТ – 04» (длина волны – 7,1 мм, частота излучения – 42,3 ГГц, плотность потока мощности облучения – 0,1 мВт/см2). Семена подвергались воздействию данного физического фактора однократно с экспозицией 30 минут [11].
Для определения влияния ЭМИ ММ при действии хлоридного засоления на всхожесть семена, после обработки выкладывались в чашке Петри по 50 штук на двойной слой фильтровальной бумаги, вливая в каждую чашку Петри по 15 мл раствора NaCl. Для проращивания семена помещали в термостат типа ТС– 80– М– 2 на 3 суток в темноту при температуре +25 0С.
Схема опыта была следующая:
Контроль 1– семена, без воздействия ЭМИ ММ и NaCl; пророщенные на дистиллированной воде;
Контроль 2 – семена, подвергнутые ЭМИ ММ, пророщенные на дистиллированной воде;
Вариант 1 – семена, с добавлением в чашки Петри 50 мМоль NaCl;
Вариант 2– семена, с добавлением в чашки Петри 100 мМоль NaCl;
Вариант 3–семена, с добавлением в чашки Петри 150 мМоль NaCl;
Вариант 4 – семена, подвергнутые ЭМИ ММ, с добавлением в чашки Петри 50 мМоль NaCl;
Вариант 5 – семена, подвергнутые ЭМИ ММ, с добавлением в чашки Петри 100 мМоль NaCl;
Вариант 6 – семена, подвергнутые ЭМИ ММ, с добавлением в чашки Петри 150 мМоль NaCl.
На 4-е сутки проростки переносили на водную культуру (среда Кнопа) и выращивали при естественном освещении в вегетационных сосудах емкостью 0,5 л.
Определение интенсивности фотосинтеза. Для измерения интенсивности фотосинтеза использовали метод ассимиляционной колбы по Л.А. Иванову и Н.Л. Коссовичу [12].
Метод основан на количестве диоксида углерода, поглощенного листьями при фотосинтезе. Опыт проводили на 14 – дневных растения пшеницы сорта Селянка.
Интенсивность фотосинтеза вычисляли по формуле:
Iф= (A — B)*K*0.55*60/(S*t)
где А – количество HCI, пошедшее на титрование барита в опытной колбе, мл; В – количество HCI, пошедшее на титрование барита в контрольной колбе, мл; К – по правка к титр у HCI; 0,55 – число мг СО2 , соответствующее 1 мл 0,025Н НС1; S – площадь листьев, дм2; t – экспозиция, мин; 60 – коэффициент перевода минут в часы.
Определение количества хлорофилла в листьях пшеницы сорта Селянка. Для того что бы определить количество хлорофилла в растениях пшеницы, был использован колориметрический метод [4].
Навеску 0,5 г свежего растительного материала тщательно растирали в фарфоровой ступке с небольшим количеством 100 %-ного ацетона (2–3 мл), чистого кварцевого песка и мела. После настаивания (2–3 мин) экстракт переносили на стеклянный фильтр № 3 и фильтровали в колбу Бунзена, соединенную с водоструйным насосом. На фильтр приливали небольшими порциями ацетон до обесцвечивания фильтрата и общего объема экстракта 10 мл.
Количество хлорофилла в вытяжке из растительного материала определяли с помощью – 56 с красным светофильтром (λ =640–750нм). В качестве контроля использовали 100 % раствор ацетона. Согласно методике был построен калибровочный график, для этого был использован стандартный раствор Гетри. Исследования проводили в трехкратной повторности, по 10 растений в каждой повторности.
Статистическую обработку полученных данных осуществляли, рассчитывая среднюю арифметическую и стандартную ошибку средней арифметической, стандартное отклонение, а также критерий достоверности Краскелла-Уолисса. Все измерения и исследования осуществляли на оборудовании, прошедшим метрологическую проверку и экспертизу.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Абиотические факторы среды оказывают влияние на интенсивность и характер протекания биолого-физиологических процессов в растениях. Фотосинтез является очень важным процессом, который определяет уровень энергетических ресурсов и метаболитов, необходимых для роста и поддерживания структур в растительной клетке. В литературе имеются данные, касающиеся влияния факторов среды на различные стороны фотосинтеза. К важнейшим стресс-факторам, лимитирующим рост и продуктивность растений, относится засоление [1, 2]. Отрицательное влияние засоления проявляется во всех физиологических процессах, однако, в разной степени. Изучение механизмов влияния высоких концентраций солей на фотосинтез в настоящее время является одним из актуальных вопросов эколого-физиологических исследований. Представляется, что устойчивость автотрофного организма, прежде всего, связана со способностью сохранять фотосинтетические системы в активном функциональном состоянии. В литературе показана различная степень влияния NaCl на интенсивность фотосинтеза многих растений [1–4].
Засоление задерживает прорастание семян, рост растений и значительно снижает их продуктивность. Отрицательное воздействие засоления обусловлено низким осмотическим потенциалом почвенного раствора, токсичностью ионов и дисбалансом питательных компонентов [13].
Засоление нарушает физиолого-биохимические процессы (водный статус, ионный и окислительно-восстановительный гомеостаз, баланс фитогормонов, проницаемость мембран) и, как следствие, тормозит рост растений [14]. Наиболее губительный эффект NaCl оказывает на ранних этапах развития растений.
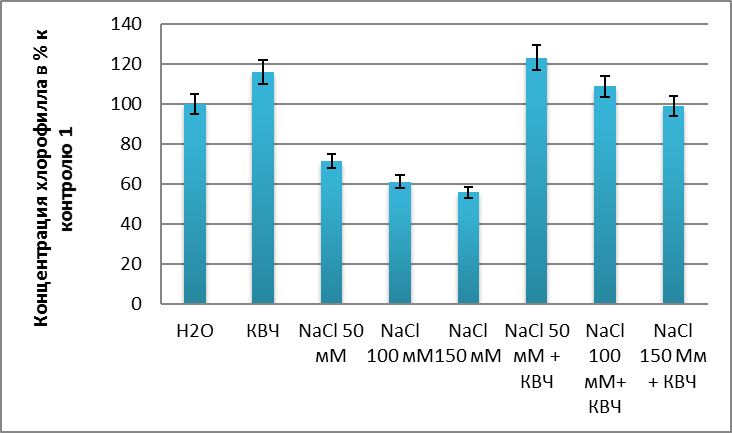
В ходе исследования было установлено стимулирующие действие низкоинтенсивного электромагнитного излучения миллиметрового диапазона на накопление хлорофилла, об свидетельствуют данные, представленные на рис. 1.
Анализируя полученные нами данные, можем утверждать о том, что при хлоридном засолении накопление хлорофилла снижается по сравнению с контролем. Так, например, при концентрации 50 мМ NaCl содержание хлорофилла в листьях Triticum aestivum L. составляет 20,3 % массы сырого вещества листьев, когда в контроле концентрация хлорофилла составила 28,4 %. Под действием ЭМИ ММ диапазона показатели увеличиваются на 51,8 % по сравнению с растениями находящиеся в осмотическом стрессе, а по сравнению с контролем накопление хлорофилла увеличивается на 23,2 %. Как свидетельствуют данные, все концентрации хлорида натрия оказывают ингибирующие действие на накопление хлорофилла в листьях Triticum aestivum L. Так, при добавлении 100 мМNaCl в питательную среду уменьшило накопления хлорофилла и составило 17,4 % массы сырого вещества, что на 39,1 % меньше по сравнению с контролем. При использовании предварительного облучения ЭМИ ММ – диапазона оказывает стимулирующий эффект на накопление хлорофилла и его содержание составило 30,9 %, что больше, чем в контрольном варианте на 46,6 %.
Рис. 1. Влияние низкоинтенсивного электромагнитного излучения миллиметрового диапазона на содержание хлорофилла в листьях Triticum aestivum L. при хлоридном засолении.
Стимулирующий эффект электромагнитного излучения наблюдается и при концентрации 150 мМ хлорида натрия. С использованием КВЧ – излучений содержание хлорофилла составила 28,2 % массы сырых листьев, на 43,3 % по сравнению с опытными вариантами без применения КВЧ-излучений.
Из выше сказанного можно утверждать что ЭМИ мм – диапазона оказывает стимулирующий эффект на накопление хлорофилла.
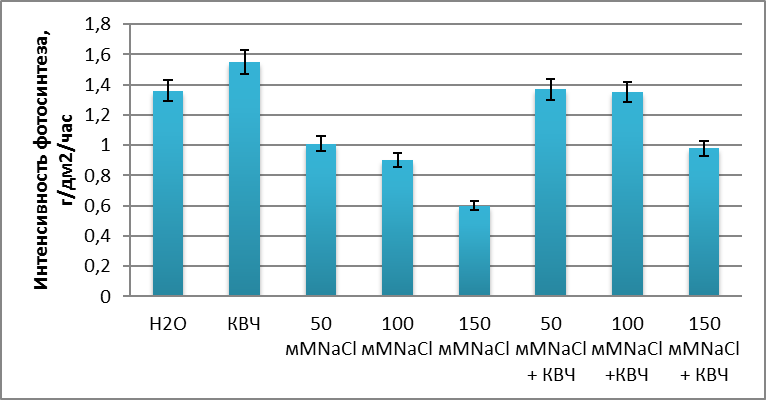
В ходе исследования, при влиянии хлоридного засоления наблюдалось снижения интенсивности фотосинтеза (рис. 2). С повышением концентрации хлорида натрия показатели значительно снижались по отношению к контролю.
Анализируя полученные нами данные, мы можем отметить, что интенсивность фотосинтеза под действием КВЧ – излучений, повышается по отношению к контролю на 14,0 %. Под действием хлоридного засоления наблюдается снижение хлорофилла, что в свою очередь снижает интенсивность фотосинтеза. Так при 50 мМNaCl продуктивность фотосинтеза составила 1,01 г/дм2/час, что на 40,0 % меньше по сравнению с растениями прошедшую предпосевную обработку КВЧ – излучениями.
При повышении содержания хлорида натрия в среде, интенсивность фотосинтеза Triticum aestivum L. снижается уже на 48 %. Уже при засолении в 150 мМ NaCl показатели составили 0,6 г/дм2/час, что на 56 % меньше контроля и на 70 % по сравнению с растениями прошедшие предварительное облучение без добавления хлорида натрия.
Так при минимальном засолении с концентрацией 50 мМ хлорида натрия получили следующие данные 1,37 г/дм2/час, что соответствует контролю и превышает продуктивность фотосинтеза растений, находящихся в осмотическом стрессе на 26,1 %. Уже при 100 мМ интенсивность фотосинтеза равна 1,35 г/дм2/час, увеличивая опытный вариант без предварительного облучения на 33,2 %. Как свидетельствуют данные, с использованием предварительного облучения семян Triticum aestivum L. наблюдается повышение продуктивности фотосинтеза с использованием концентрации 150 мМ NaCl. Так интенсивность фотосинтеза составила 0,98 г/дм2/час и увеличивается по сравнению с опытными экземплярами, находящиеся в осмотическом стрессе, на 28,2 %.
Рис. 2. Влияние низкоинтенсивного электромагнитного излучения миллиметрового диапазона на интенсивность фотосинтеза Triticum aestivum L. в условиях хлоридного засоления.
Анализируя полученные данные, можем сделать вывод о том, чтонизкоинтенсивное электромагнитное излучение миллиметрового диапазона оказывает стимулирующий эффектна интенсивность фотосинтеза Triticum aestivum L. в условиях хлоридного засоления.
ЗАКЛЮЧЕНИЕ
Установлено положительное действие низкоинтенсивного электромагнитного излучения миллиметрвого диапазона на пигментный состав и фотосинтетическую активность Triticum aestivum L. как в оптимальных условиях, так и в условиях осмотического стресса. Полученные результаты по количественному содержанию хлорофиллов показали, что их содержание возрастало как в нормальных условиях, так и при осмотическом стрессе в среднем на 20 %. Установлено повышение интенсивности фотосинтеза у опытных растений на 30,0 % по сравнению с контрольными растениями при осмотическом стрессе.
Работа выполнена на базе ЦКП «Экспериментальная физиология и биофизика» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского»
REFERENCES
- Safina G. R., Fedorov V. A. State administration and protection of Russian land resources at present: lecture course. Part 3. Land and land degradation. Melioration, 135 s. (Kazan: Kazan u.s., 2020).
- Scientific bases for preventing soil (land) degradation of Russian agricultural land and establishing fertility reproduction systems in adaptive and landscape agriculture: T. 1. Theoretical and methodological bases for preventing soil (land) degradation agricultural land. Collective monograph. 756 s. (M.: Soils. in-t. V.V. Dokuchaeva Rosselkhozakamemia, 2013).
- Lebedeva M. P., Shuyskaya E. V., Toderich K. N. Soil forming processes and genetic diversity of Haloxylon aphyllum in the deserts of Uzbekistan. In the Book: Land Resources and Food security of Central Asia and Southern Caucasus, 370 (Eds: Pavel Krasilnikov, Maria Konyushkova and Ronald Vargas, 2016).
- Chudinova L. A., Orlova N.V. Plant Resistance Physiology: Training Manual for Special Course, 84, 124 s. (Perm. un-t. Perm, 2006).
- Dukovsky P., Yuknis R., Brazaitet A., Jukauskaite I. Plant reaction to complex influence of natural and anthropogenic stressors, Plant physiology., 50, 32, 165 (2003).
- Koshkin E. I. Physiology of the stability of agricultural plants. Cell breeding with heavy metal ions: new aspects of complex stability, Mater. X International Conference «Plant Cell Biology in vitro and Biotechnology», 82 (Kazan, 2013).
- Shchupletsova O. N., Krasnoy I. G. Increasing the resistance of cells to metal toxicity and osmotic stress by cell breeding, Cereals of Russia, 1, 124 (2015).
- Maslobrod C. N., Korlatchanu L. B., Ghana A. I. The influence of millimetre radiation on plant vitality. 1. Changes in the metabolism of seeds due to the influence of a factor on dry seeds, Electronic processing of materials, 46(5), 93 (2010).
- Kale M. I. Possible mechanism for developing a response of germinating seed crops to the effects of CF radiation, Topical problems of the humanities and natural sciences, 5, 332 (2011).
- Alexandrov V. V. Ecological Role of Electromagnetism, 736 s. (SPb.: Polytechnic. – University, 2010).
- Ivanov L. A., Kossovich N. A. Field method for determining photosynthesis in assimilation flask, Jurn., 31, 5, 3 (1946).
- Kalinin N. G., Boshkov I. L., Panchenko G. I., Kolomiychuk S. G. Influence of low frequency and high frequency electromagnetic field on seeds, Biophysics, 50 (2), 361 (2005).
- Ivanishov V. V. On mechanisms of salt resistance of plants and specifics of influence of salinization, News of Tula State University. Natural sciences, 4, 74 (2019).
- Shokri-Gharelo R., Noparvar P. M. Molecular response of canola to salt stress: insights on tolerance mechanisms, , 6, e4822 (2018). https://doi.org/10.7717/peerj.4822
- Tambiyev A. X., Kirikov N. N. General patterns of action of HFC radiation on photosynthetic objects, International Symposium on Millimetre Waves in Biology and Medicine, 100 (M.: IREE RAS, 2003).