INFRADIAN RHYTHMS OF DEPRESSIVE-LIKE BEHAVIOR IN RATS
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №3, 2021
Publication text (PDF):Download
UDK: 57.024; 57.034; 611.81
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Chajka A. V., Krasnolesie Crimean College of Olympic Reserve, Simferopol district, Russian Federation
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-3-250-261
PAGES:from 250 to 261
STATUS:Published
LANGUAGE:Russian
KEYWORDS: depression, chronic mild unpredictable stress, dopamine, D2-receptors, biorhythms.
ABSTRACT (ENGLISH):
It is customary to check the effectiveness of antidepressant substances in preclinical experimental tests on key days, often weekly [1, 2], or according to the “before-after” scheme [3], without taking into account the daily dynamics of behavior. Such studies are typical, to a greater extent, for the clinic and practically have no analogues when working with laboratory animals. Understanding how specific treatments for depression affect not only quantitatively on certain days, but also qualitatively on the dynamics of symptoms of the disease in general, will help to see the big picture and better select antidepressants and predict their effectiveness.
The study of the fundamental rhythmological features of the course of depressive disorders is also an important issue because the endogenous part of the biological clock system makes it possible to predict future stress effects and to react homeostatically to them proactively, and not only reactively [4]. It has been established that the organism of animals (including humans) is characterized by rhythmic fluctuations of functional parameters, rhythmic disturbances of which can lead to a decrease in adaptive capabilities, maladjustment and the development of various diseases [5]. In the modern literature there are a number of works proving the participation of biorhythms in the pathogenesis of depression [6–8] and the presence of rhythmic changes in the manifestation of symptoms of this disease [9–11].
Much is known and written about circadian rhythms, which has contributed to a better understanding of how the physiology of living organisms’ changes over the course of twenty-four hours. It is less clear whether and how physical and mental parameters in animals change on a larger time scale [12]. It is only recently that attention has been paid to the study of not only circadian (≤ 28 h), but also longer infradian biorhythms, which is promising for the development of chronobiological approaches to the diagnosis and correction of somatic and mental diseases [13]. Moreover, most biorhythmological studies are devoted to assessing the body’s reactions to the impact of various factors of meteorological and geomagnetic nature [14], but not factors of a mental and chemical nature.
The experiments were carried out on 60 male Wistar rats weighing 200-250 g, divided into 6 equal groups (n = 10): “control 3”, “stress 2”, “haloperidol 2”, “stress + amitriptyline”, “haloperidol + amitriptyline” and “stress + haloperidol”. Also, the final biorhythmological analysis included data from previous studies, which had already been partially published earlier [15, 16]: groups (n = 10) “control 1”, “control 2”, “stress 1” and “haloperidol 1” — in order to check the reproducibility of the data and reduce the likelihood of the influence of random (atypical) fluctuations on the final conclusions.
The “stress” groups were subjected to chronic, unpredictable mild stress for 21 days, according to the previously described method [16].
Selective D2-receptor blocker haloperidol (“Haloperidol”, N. A. Semashko Moskhimpharmpreparaty, Russia) was administered for 24 days (3 days of preliminary administration to achieve a high % of blocked receptors) at a dose of 2.5 mg/kg.
The tricyclic antidepressant amitriptyline (Amitriptyline Hydrochloride, Sigma-Aldrich, USA) was administered for 21 days at a dose of 15 mg/kg.
All substances were diluted in saline and injected intraperitoneally in a volume of 0.2 ml/animal 30 minutes before testing. The control group received saline solution in the same volume. With the combined administration of several substances, a break of 30 minutes was made between injections.
Starting from the 4th day of the experiment, the behavior of the animals was examined daily in the Forsed swim test (FST), 30 minutes after the last injection. Testing duration – 3 minutes (shortened procedure) [17, 18]; the time of immobility was recorded in seconds.
The significance of differences between groups was determined using the Mann-Whitney test or Student’s t test, according to the nature of the distribution of the data. The calculations and visualization of the results were carried out in the GraphPad Prism 8. The rhythmic component in the data dynamics was determined using Fourier spectral analysis in the STATISTICA 10.
Studying the graphs of immobility dynamics in the FST caused by chronic stress and blockade of D2-like receptors, it becomes obvious that the level of depression in animals has a pronounced periodicity.
From these data, it follows that the dynamics of the immobility time in FST:
- It is largely characterized by semi-weekly (2.5–3.5 days) and weekly (7 ± 3 days) rhythmic changes.
- In the groups “haloperidol” and “stress + haloperidol”, in contrast to the others, there is no rhythm of 4.40 days.
- In the groups “stress”, “haloperidol”, and partly “stress + haloperidol” and “stress + amitriptyline”, longer rhythms are pronounced – 5.50, 7.33 and 11.00 days.
- In the groups with stress and haloperidol, there are smaller rhythms with a duration of 2.00 and 2.20 days, which are not in the control.
Stress factors can also cause phase shifts in the studied parameters [19]. Similar changes were observed in this study, both in the stress group and in the haloperidol group.
Chronic blockade of D2-like receptors changes the adaptive mechanisms of the rat organism: in the temporal dynamics of the immobility level in FST, the 4-day rhythm typical for the physiological systems of many animals disappears, but a stress-induced 2-day rhythm occurs, and a phase shift in the level of immobility compared with control animals. This characterizes the chronic blockade of D2-like receptors as a powerful stress factor causing depression-like behavior in rats, and indicates a significant contribution of the central dopaminergic system to the infradian rhythm of this behavior.
ВВЕДЕНИЕ
Эффективность антидепрессантных веществ в доклинических экспериментальных тестах принято проверять в ключевые дни, зачастую, еженедельно [1, 2], либо по схеме «до-после» [3], не принимая в расчёт ежедневную динамику поведенческих показателей. Таковые исследования характерны, в большей мере, для клиники и практически не имеют аналогов при работе с лабораторными животными. Учёт того, как конкретные методы лечения депрессии воздействуют не только количественно в определённые дни, но и качественно на динамику симптомов заболевания в целом, даст возможность увидеть картину в общем, лучше подбирать антидепрессанты и прогнозировать их эффективность.
Изучение фундаментальных биоритмологических особенностей протекания депрессивных расстройств является важным вопросом ещё и потому, что эндогенная часть системы биологических часов позволяет прогнозировать будущие стресс-воздействия и гомеостатически реагировать на них упреждающе, а не только реактивно [4]. Установлено, что для организма животных (в т. ч. и человека) характерны ритмические колебания функциональных параметров, нарушения ритмичности которых могут приводить к снижению адаптационных возможностей, дезадаптации и развитию различных заболеваний [5]. В современной литературе присутствует ряд работ, доказывающих участие биоритмов в патогенезе депрессии [6–8] и наличие ритмических изменений в проявлении симптомов этого заболевания [9–11].
Многое известно и написано о циркадных ритмах, что поспособствовало лучшему пониманию того, как изменяется физиология живых организмов в течение двадцати четырёх часов. Менее понятно, изменяются ли (и как?) физические и психические показатели у животных в большем временном масштабе [12]. Лишь недавно стало уделяется внимание изучению не только циркадных (≤ 28 ч), но и более длительных инфрадианных биоритмов, что перспективно для разработки хронобиологических подходов к диагностике и коррекции соматических и психических заболеваний [13]. Более того, большинство биоритмологических исследований посвящено оценке реакций организма на воздействие различных факторов метеорологической и геомагнитной природы [14], но не факторов психической и химической природы. Таким образом, целью данного исследования было изучение инфрадианной ритмики в протекании депрессивноподобного поведения у крыс, вызванного хроническими стрессорами фармакологического и психосоциального происхождения.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проведены на 60 крысах-самцах Вистар массой 200–250 г, разделённых на 6 равных групп (n=10): «контроль 3», «стресс 2», «галоперидол 2», «стресс+амитриптилин», «галоперидол+амитриптилин» и «стресс+галоперидол». Также в итоговый биоритмологический анализ были включены данные из предыдущих исследований, которые уже были частично опубликованы ранее [15, 16]: группы (n=10) «контроль 1», «контроль 2», «стресс 1» и «галоперидол 1» – с целью проверить воспроизводимость данных и снизить вероятность влияния случайных (нетипичных) флуктуаций на итоговые выводы.
Группа «стресс» на протяжении 21 дня подвергалась хроническому непредсказуемому умеренному стрессу, по описанной ранее методике [16].
Селективный блокатор D2-рецепторов галоперидол («Галоперидол», Мосхимфармпрепараты им. Н. А. Семашко, Россия) вводился в течение 24 дней (3 дня предварительного введения для достижения высокого % заблокированных рецепторов) в дозе 2,5 мг/кг.
Трициклический антидепрессант амитриптилин («Amitriptyline Hydrochloride», Sigma-Aldrich, США) вводился в течение 21 дня в дозе 15 мг/кг.
Вещества разводились в физрастворе и вводились внутрибрюшинно в объёме 0,2 мл/животное за 30 мин до начала тестирования. Контрольная группа получала физраствор в аналогичном объёме. При сочетанном введении двух веществ между инъекциями производился перерыв в 30 мин.
Начиная с 4-го дня эксперимента, поведение животных ежедневно исследовали в «Тесте Порсолта», через 30 мин после инъекций. Установка данного теста представляет собой прозрачный цилиндр из оргстекла высотой 45 см и диаметром 20 см (НПК «Открытая Наука», Россия). Цилиндр заполняли на 2/3 водой температурой +22±1°С. Длительность тестирования – 3 минуты (укороченная процедура) [17, 18]; регистрировалось время иммобильности в секундах.
Достоверность различий между группами определялась с помощью критерия Манна-Уитни или теста Стьюдента, согласно характеру распределения данных. Расчёты и визуализация результатов проведены в программе GraphPad Prism 8. Ритмический компонент в динамике данных определяли с помощью спектрального анализа Фурье в программе STATISTICA 10.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
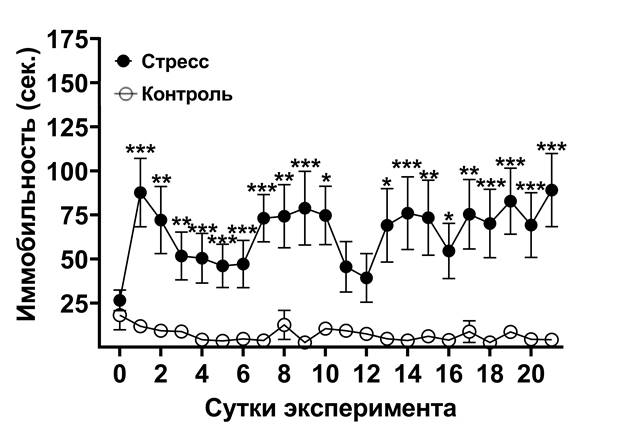
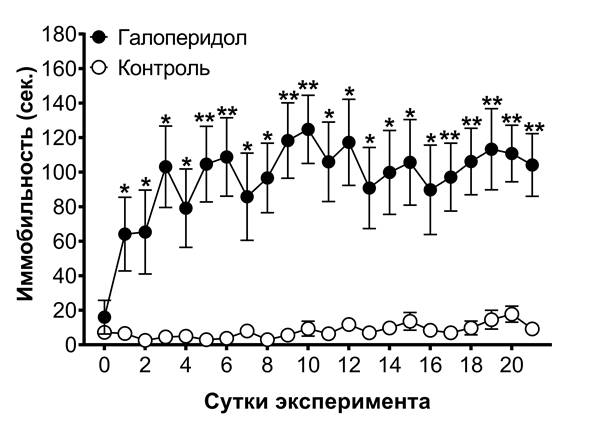
Изучая графики по динамике иммобильности в «Тесте Порсолта», вызванной хроническим стрессом и блокадой D2-подобных рецепторов, становится очевидным, что уровень депрессивности у животных обладает выраженной периодичностью (рис. 1–2).
Рис. 1. Динамика времени иммобильности в группах «стресс 2» и «контроль 2» во втором эксперименте.
Примечание: звёздочками отмечены достоверные отличия при *p<0,05, **р<0,01, ***р<0,001 между группами «контроль» и «стресс» (критерий Стьюдента).
Для чёткого установления данных периодов был использован анализ Фурье. Полученные результаты представлены в таблице.
Рис. 2. Динамика времени иммобильности в группах «контроль 3» и «галоперидол 2».
Примечание: звёздочками отмечены достоверные отличия при *p<0,05, **р<0,01, между группами «контроль» и «галоперидол» (критерий Манна-Уитни).
Таблица
Результаты анализа Фурье
| Воздействие | Группа | Основные ритмы (дни) | Доминирующие ритмы (дни) | |||||
| Блокада D2—подобных рецепторов | Галоперидол 1 | 3,67 (1285)* | 7,33
3,67 2,20 |
|||||
| 7,33 (1046) | ||||||||
| 2,44 (365) | ||||||||
| Галоперидол 2 | 7,33 (1384) | |||||||
| 2,20 (866) | ||||||||
| Галоперидол 1 + Галоперидол 2 | 7,33 (1086) | |||||||
| 3,67 (837) | ||||||||
| 2,20 (320) | ||||||||
| Хронический умеренный непредсказуемый стресс | Стресс 1 | 11,00 (3534) | ||||||
| 2,75 (1389) | ||||||||
| 4,40 (861) | ||||||||
| Хронический умеренный непредсказуемый стресс | Стресс 2 | 7,33 (1196) | 2,75
11,00 2,00 4,40 |
|||||
| 2,00 (723) | ||||||||
| 2,75 (296) | ||||||||
| Стресс 1 + Стресс 2 | 2,75 (687) | |||||||
| 2,00 (670) | ||||||||
| 11,00 (558) | ||||||||
| 4,40 (251) | ||||||||
| Контроль | Контроль 1 | 7,33 (403) | 2,44
3,67 7,33 11,00 4,40 |
|||||
| 3,67 (342) | ||||||||
| 2,44 (100) | ||||||||
| Контроль 2 | 2,44 (25) | |||||||
| 4,4 (24) | ||||||||
| 11,00 (16,5) | ||||||||
| Контроль 3 | 11,00 (144) | |||||||
| 4,40 (133) | ||||||||
| 2,75 (43) | ||||||||
| Контроль (1+2+3) | 3,67 (66) | |||||||
| 7,33 (49) | ||||||||
| 2,44 (31) | ||||||||
| Смешанное | Стресс +
Амитриптилин |
7,33 (339) | 7,33
4,40 2,75 2,00 |
|||||
| 4,40 (291) | ||||||||
| 2,75 (192) | ||||||||
| 2,00 (96) | ||||||||
| Галоперидол +
Амитриптилин |
2,44 (1843) | 2,44
4,40 2,00 |
||||||
| 4,40 (667) | ||||||||
| 2,00 (504) | ||||||||
| Стресс + Галоперидол | 2,00 (2115) | 2,00
5,50 11,00 2,75 |
||||||
| 5,50 (1131) | ||||||||
| 11,00 (1105) | ||||||||
| 2,75 (978) | ||||||||
Примечание: (*) – в скобочках указаны значения периодограммы.
Из этих данных следует, что динамика времени иммобильности в «Тесте Порсолта»:
- Во многом характеризуется полунедельными (2,5–3,5 дня) и недельными (7±3 дня) ритмическими изменениями.
Известно, что целый ряд биоритмов длительностью от 2,74±0,24 до 7,20±0,30 дней обусловлен изменением в секреции и экскреции гормонов надпочечников [5], и катехоламинов в целом [19], к которым относится и дофамин. Особенно часто встречается 4-дневный ритм, который также присутствует и в колебаниях уровня мелатонина [20]. Ритмы длительностью в 3–7 дней также наблюдаются в уровне депрессивности и тревожности у людей. Правда эти ритмы по значимости и распространённости уступают более крупным (продолжительным) ритмам [21].
- В группах «галоперидол» и «стресс+галоперидол», в отличие от остальных, не содержится ритма 4,40 дня.
В организме крыс Вистар 4-суточные периоды характерны практически для всех физиологических систем. Вероятно, чередование подъёмов и спадов, напряжения и расслабления периодичностью в 4 суток эффективно защищает организм от различных перегрузок [22]. Объяснение этому эффекту может заключаться в том, что под действием некоторых стрессоров определённые ритмы могут исчезать [19]. Амитриптилин возвращает ритм 4,40 на фоне введения галоперидола, что может говорить о его адаптогенном эффекте.
- В группах «стресс», «галоперидол», и отчасти «стресс+галоперидол» и «стресс+амитриптилин» ярко выражены более длинные ритмы – 5,50, 7,33 и 11,00 дней.
Известно, что результатом воздействия стрессоров может быть удлинение биоритмов, т.к. необходимо больше времени для отдыха и восстановления, и эти периоды выступают в роли «амортизаторов» [23]. Установлено, что активация дофаминергической системы метамфетамином удлиняет ультрадианные биоритмы двигательной активности, а блокада D2-подобных рецепторов галоперидолом – укорачивает [24]. Возможно, с инфрадианными ритмами этот принцип не работает. Есть основания предполагать, что происходит удлинение одних биоритмов на фоне возникновения других – более коротких (2,00–2,20 дня) и общее действие становится модулирующим.
- В группах со стрессом и галоперидолом встречаются более мелкие ритмы длительностью в 2,00 и 2,20 дня, которых нет в контроле.
Литературные данные крайне скудно описывают значимость этих ритмов, и в классической классификации таких ритмов вообще нет: циркадные ритмы заканчиваются на 28 часах, а следующие за ними полунедельные ритмы начинаются сразу минимум с 2,5 дней.
Согласно теории В. И. Чумакова и соавт., 48-часовой ритм является следствием исключительно некоего сильного стресс-воздействия на организм, и в норме не проявляется. Этот ритм неспецифический (типичен для разных стрессоров и организмов разной сложности организации), эндогенный, и характеризуется полным периодом колебания (подъём/спад). Первая половина (полупериод) ритма (подъём) связана с активизацией симпатической системы, что влечёт за собой увеличение концентрации адренокортикотропного гормона, кортизола, количества лейкоцитов, изменения в уровне натрия в плазме крови и т.п. Однако, это вызывает сильное напряжение всех систем организма и не может длиться долго, поэтому во второй полупериод ритма происходит спад – тонус симпатической системы снижается, а парасимпатической повышается, которая влияет на уровень глюкозы и калия в крови, проницаемость капилляров и т.п. [25].
Данные Фурье анализа по текущему исследованию согласуются с этой теорией: 2-дневные ритмы тем ярче выражены, чем сильнее стресс. Поэтому в группе «стресс+галоперидол» этот ритм доминирующий, а введение амитриптилина снижает его значимость, что в случае с хроническим стрессом, что в случае с блокадой D2-подобных рецепторов.
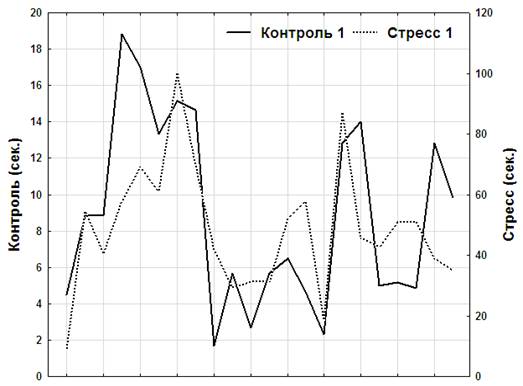
Стресс-факторы могут также вызывать и фазовые сдвиги в исследуемых показателях [19]. Подобные изменения наблюдались и в данном исследовании, что в группе «стресс» (рис. 3), что в группе «галоперидол».
Рис. 3. Фазовый сдвиг уровня иммобильности в группе «стресс».
ЗАКЛЮЧЕНИЕ
Хроническая блокада D2-подобных рецепторов изменяет адаптационные механизмы организма крыс: во временной динамике уровня иммобильности в «Тесте Порсолта» исчезает типичный для физиологических систем многих животных 4-дневный ритм, но возникает стресс-вызванный 2-дневный ритм, а также наблюдается фазовый сдвиг в уровне иммобильности по сравнению с контрольными животными. Это характеризует хроническую блокаду D2-подобных рецепторов как мощный стресс-фактор, вызывающий депрессивноподобное поведение у крыс, и указывает на значимый вклад центральной дофаминергической системы в инфрадианную ритмику такого поведения.
Работа выполнена на оборудовании ЦКП ФГАОУ ВО «КФУ им. В. И. Вернадского» «Экспериментальная физиология и биофизика».
Работа выполнена в рамках темы АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности»
REFERENCES
- Wang J. M., Yang L. H., Zhang Y. Y., Niu C. L., Cui Y., Feng W. S., & Wang G. F. BDNF and COX-2 participate in anti-depressive mechanisms of catalpol in rats undergoing chronic unpredictable mild stress. Physiology & behavior, 151, 360 (2015).
- Haraguchi A., Fukuzawa M., Iwami S., Nishimura Y., Motohashi H., Tahara Y., & Shibata S. Night eating model shows time-specific depression-like behavior in the forced swimming test. Scientific reports, 8(1), 1081 (2018).
- Y., Li C. Y., Ruan Y. P., Sun M., Qi X. L., Zhao B. S., & Luo F. Chronic treatment with celecoxib reverses chronic unpredictable stress-induced depressive-like behavior via reducing cyclooxygenase-2 expression in rat brain. European journal of pharmacology, 612(1-3), 54 (2009).
- Miyake T., & Doi M. Reconstitution of organismal liver clock function requires light. Trends in Endocrinology & Metabolism, 30(9), 569 (2019).
- Diatroptov M. E., Kondashevskaya M. V., Mkhitarov V. A. Infradian biorhythms of structure-functional changes of the adrenal cortex zones of mature males Wistar rat. Clinical and Experimental Morphology, 2, 27 (2014).
- Bunney J. N., & Potkin S. G. Circadian abnormalities, molecular clock genes and chronobiological treatments in depression. British medical bulletin, 86(1), 23 (2008).
- Leach G., Adidharma W., & Yan L. Depression-like responses induced by daytime light deficiency in the diurnal grass rat (Arvicanthis niloticus). PLoS One, 8(2), e57115 (2013).
- Logan R. W., Edgar N., Gillman A. G., Hoffman D., Zhu X., & McClung C. A. Chronic stress induces brain region-specific alterations of molecular rhythms that correlate with depression-like behavior in mice. Biological psychiatry, 78(4), 249 (2015).
- Nutt D. J., Bell C., Potokar J. Depression, anxiety and the mixed conditions (London: Martin Dunitz, 1997), 72 pp.
- Minutko V. L. Depression (GEOTAR-Media, Moscow, 2006), 320 pp.
- Tyuvina N. A., Korobkova I. G. Comparative clinical characteristics of depression in bipolar affective disorders types I and II. Nevrologiya, neiropsikhiatriya, psikhosomatika = Neurology, neuropsychiatry, psychosomatics, 8(1), 22 (2016).
- Barber C. F. A review and applications of monthly circadian rhythms. Journal of psychiatric and mental health nursing, 17(3), 274 (2010).
- Rapoport S. I. Frolov V. A., Khetagurova L. G. Chronobiology and chronomedicine (MIA Publishing house, Moscow, 2012), 480 pp.
- Dudin S. A. Infradian rhythms in medical ambulance team dispatches. Izvestiya, Atmospheric and Oceanic Physics, 48(8), 810 (2012).
- Chaika A. V., Khusainov D. R., Cheretaev I. V., Korenyuk I. I., & Nozdrachev A. D. Chronic Blockade of D2 Receptors and Behavior in Low-Depressivity Rats. Neuroscience and Behavioral Physiology, 48(5), 564 (2018).
- Chajka A. V., Konoshenko E. V, Khusainov D. R., Shakhmatova V. I., Mozharovskaya I. A., Cheretaev I. V. Forced swim test as a longitude method of assessment the dynamics of the emotional state of rats in the model of chronic unpredictable mild stress. Scientific Notes of V. I. Vernadsky Crimean Federal University. Biology. Chemistry, 4(70), 2, 133 (2018).
- Kalueff A. V. Stress, anxiety and behavior, 95 p. (Kyiv: Enigma, 1998).
- Frolova G. A. Comparative ethological characteristics of males and females of white rats in Porsolt test in blocking receptors of sex hormone, Vestnik VGU, Seriya: Khimiya. Biologiya. Farmatsiya, 4, 110 (2016).
- Shishko E. Yu., Malygina V. I. Infradian rhythm of the sympathoadrenal system in hypokinetic stress. Scientific Notes of V. I. Vernadsky TNU. Series: Biology, Chemistry, 17(1), 108 (2004).
- Diatroptov M. E., Diatroptova M. A. Multiday biorhythms of the morphofunctional state of the thymus, the level of melatonin and corticosterone in male Wistar rats. Bulletin of the Northern State Medical University, 111 (2013).
- Eastwood M. R., Whitton J. L., Kramer P. M., & Peter A. M. Infradian rhythms: a comparison of affective disorders and normal persons. Archives of general psychiatry, 42(3), 295 (1985).
- Diatroptov M. E., Kondashevskaya M. V. Infradian rhythmics of markers of physiologic and metabolic processes in Vistar male rats. Russian Journal of Physiology, 98(3), 410 (2012).
- Shurlygina A. V. Fundamentals of chronobiology and chronomedicine in tables and diagrams: a methodological guide (NSU, Novosibirsk, 2001), 32 pp.
- Blum I. D., Zhu L., Moquin L., Kokoeva, M. V., Gratton, A., Giros, B., & Storch, K. F. (2014). A highly tunable dopaminergic oscillator generates ultradian rhythms of behavioral arousal. Elife, 3, e05105.
- Chumakov V. I., Soldatov A. A., & Dymochkin V. N. Does the 48-hour biological rhythm exist? Human Physiology, 26(4), 488 (2000).